الکتروشیمی
الکتروشیمی را علم استفاده از انرژی الکتریکی برای انجام یک تغییر شیمیایی یا تولید انرژی الکتریکی به وسیله واکنش های شیمیایی تعریف می کنند.
بسیاری از مشاهده های روزانه مانند پدیده ی رعد و برق از ارتباط شیمی و الکتریسیته حکایت دارد و همچنین علاقمندی دانشمند بزرگ، مایکل فارادی به شیمی و الکتریسیته و تلاش او برای برقراری ارتباط میان این دو رشته موجب پیدایش شاخه ای در علم به نام الکتروشیمی شد.

الکتروشیمی علم استفاده از انرژی الکتریکی برای انجام یک تغییر شیمیایی یا تولید انرژی الکتریکی بوسیله ی واکنش های شیمیایی است.
واکنش های شیمیایی مورد نظر درالکتروشیمی همگی از نوع اکسایش_کاهش هستند.
واکنش های اکسایش و کاهش همراه با تبادل یا انتقال الکترون است.
اگر عنصری الکترون بگیرد می گوییم می گوییم کاهش یافته یا کاهیده (احیا) شده است.
اگر عنصری الکترون از دست بدهد می گوییم اکسایش یافته یا اکسید شده است.
“واکنش سوختن منیزیم در اکسیژن نمونه از واکنش های اکسایش_کاهش است”
2Mg(s) +O2(g) → 2MgO(s)
2Mg(s) → 2Mg2+ +4e
نیم واکنش اکسایش (الکترون از دست داده)
O2(g) +4e– → 2O2- (s)
نیم واکنش کاهش (الکترون گرفته )
سلول های الکتروشیمیایی
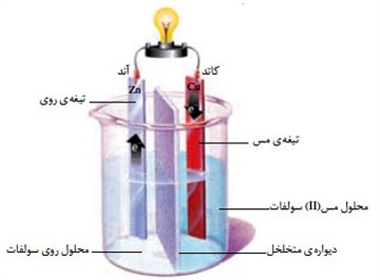
به مجموعه ی دو نیم سول که به هم متصل می شوند سلول الکتروشیمیایی می گویند.
سلول الکتروشیمیایی شامل:
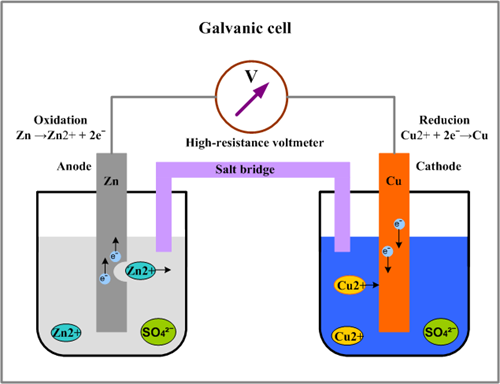
- دو الکترود رسانا (آند و کاتد) در آند همیشه نیم واکنش اکسایش رخ می دهد ودر کاتد نیم واکنش کاهش رخ می دهد
- محلول الکترولیت
- پل نمکی (اتصالات الکتریکی و رسانش برقرار می کند)
- سیم های رابط
- ولت سنج (جهت جریان در ولت سنج همواره از سمت آند به کاتد است)
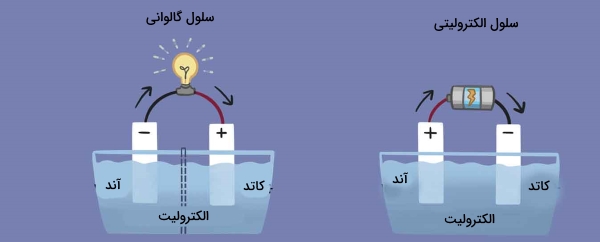
انواع سلول های الکتروشیمیایی
الف) سلول الکترولیتی
ب) سلول گالوانیک (گالوانی)
در سلول گالوانیک :
- الکتریسیته تولید می شود یعنی انرژی شیمیایی به الکتریکی تبدیل میشود
- جریان الکترون از آند به کاتد می باشد
- واکنش ها خودبه خودی صورت می گیرد
- پتانسیل از لحاظ عددی مثبت است
در سلول الکترولیتی :
- الکتریسیته اعمال می شود یعنی نیاز به یک منبع خارجی می باشد
- جریان الکترون از آند به کاتد می باشد
- واکنش غیر خودبه خودی است
- ولت متر عددی منفی است