واکنش مرتبه اول چگونه واکنشی است؟
فرض کنید یک واکنش مرتبه اول به صورت زیر داشته باشیم که در آن a و b ضرایب استوکیومتری مواد A و B و k ثابت سرعت انجام واکنش باشد.
در این صورت برای بیان سرعت انجام واکنش، از نسبت تغییرات غلظت یکی از گونه ها، نسبت به زمان استفاده می کنیم و داریم:
علامت منفی بخاطر این است که در طی واکنش غلظت گونه A کاهش می یابد. به طور مشابه برای گونه B داریم:
در اینجا عدم وجود علامت منفی بخاطر این است که در گذر زمان، گونه B تولید می شود. همچنین برای بیان سرعت این واکنش می توان از رابطه قانون سرعت به صورت زیر استفاده کرد و داریم:
از قرار دادن تساوی بین دو معادله مربوط به R داریم:
در این صورت به ازای ضریب استوکیومتری 1 برای گونه A داریم:
می توان از قسمت آخر معادله انتگرال گرفت؛ در این صورت داریم:
با حل انتگرال در نهایت داریم:
اگر از دو طرف معادله e بگیریم در نهایت داریم:
با رابطه (قسمت آبی رنگ) بالا می توان غلظت گونه A را در هر لحظه محاسبه کرد.
زمان نیمه عمر: مدت زمانی که طول می کشد تا غلظت گونه واکنش دهنده به نصف مقدار اولیه اش برسد.
در یک واکنش مرتبه اول برای زمان نیمه عمر داریم:
اگر غلظت گونه B بر حسب زمان را برای یک واکنش مرتبه اول رسم کنیم داریم:
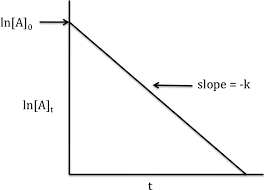
در این نمودار، شیب خط برابر با k است. توجه کنید که اگر همین نمودار را برای گونه A رسم کنیم. از صفر شروع می شود و با همین شیب به بالا می رود.