[vc_row][vc_column][vc_column_text]
کربن۴الکترون در لایه ظرفیت خود دارد که به صورت نقطه در اطراف نماد آن قرار میگیرد.
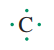
اگرقرارباشد پیوند کوالانسی بین کربن واتم های دیگر تشکیل شود باید اتم های درگیردرتشکیل پیوند با اتم کربن،یکی از الکترون های ظرفیت خود را با یکی از این الکترون های ظرفیت اتم کربن به اشتراک گذاشته تا یک پیوند کوالانسی بین دواتم تشکیل شود و هر کدام به آرایش گاز نجیب مربوطه برسند وساختار ۸تایی را کسب کنند.
برای مثال در ملکول متان ۴ اتم هیدروژن ،تک الکترون موجود در لایه ظرفیت خود را با ۴الکترون ظرفیت کربن به اشتراک گذاشته وچهار پیوند کوالانسی تشکیل می دهند.
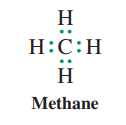
به این ترتیب کربن هم از قاعده ۸تایی پیروی کرده و به پایداری میرسد.
در شیمی آلی،اتم کربن بیشتربا اتم هایی از جمله خود کربن،هالوژن ها (فلوئور،کلر،برم،ید) هیدروژن و…… پیوند میدهد که همانطور که گفته شد،به ازای تشکیل یک پیوند کوالانسی بین کربن و اتم متقابل بایستی هرکدام یک الکترون به اشتراک بگذارند.
اکنون بحث طول پیوند مطرح میشود که طول پیوند کربن با چند اتم رایج در شیمی آلی در زیر بررسی میشود.
طول پیوند کربن با کربن:۱۲۰-۱۵۴
طول پیوند کربن با هیدروژن:۱۱۲-۱۰۶
طول پیوند کربن با فلوئور: ۱۳۴
طول پیوند کربن با کلر:۱۷۶
طول پیوند کربن با برم :۱۹۳
طول پیوند کربن با ید:۲۱۳
علاوه بر تشکیل پیوند دو الکترونی یا یگانه،اتم کربن توانایی تشکیل پیوندهای چهار الکترونی یا دوگانه و شش الکترونی یا سه گانه را نیز دارا میباشد که در تشکیل پیوند دوگانه،اتم کربن و اتم مقابل آن بایستی هر کدام دوالکترون به اشتراک بگذارند و در پیوند سه گانه هر کدام از دو اتم سه الکترون به اشتراک بگذارند.
نکته قابل توجه این است که طول پیوند کربن-کربن سه گانه کوتاه ترازطول پیوند دوگانه کربن -کربن میباشد وطول پیوند یگانه کربن-کربن بلندتر از این دو میباشد.
رسم ملکولها به همراه جفت الکترون های ظرفیت بصورت نقطه،همانطورکه برای متان نشان داده شد، به ساختار لوییس موسوم است.

کاملترین پیوند کوالانسی بین دو اتم با الکترونگاتیوی یکسان صورت میگیرد. پس هنگامی که دو اتم کربن باهم پیوند میدهند، یک پیوند کاملا کوالانسی تشکیل میشود.
اتم کربن با اتم های دیگری هم تشکیل پیوند کوالانسی میدهد که منجر به قطبش آنها شده چرا که هرکدام الکترونگاتیوی متفاوت دارند.
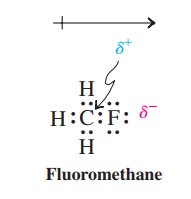
هرکدام الکترونگاتیوی کمتری داشته جزیی بار مثبت گرفته و دیگری با الکترونگاتیوی بیشتر جزیی بار منفی میگیرد. مثلا در پیوند کوالانسی تشکیل شده بین اتم فلوئور و کربن در ملکول فلوئورو متان کربن الکترونگاتیوی کمتری نسبت به فلوئورداشته پس دارای جزیی بار مثبت میباشد.ولی فلوئوردارای جزیی بار منفی است.این جدایی بارهای مخالف که دوقطبی الکتریکی نامیده میشود،توسط فلشی که دارای انتهای مثبت بوده و جهت آن،از بار مثبت به طرف بار منفی است،نشان داده میشود.
ٰ
کربن ،هم میتواند جزیی بار مثبت و هم جزیی بار منفی بگیرد که در صورت اینکه جزیی بار مثبت داشته باشد به آن کربوکاتیون و در صورتی که جزیی بار منفی گیرد به آن کربانیون گویند.
طبق روش دافعه جفت الکترون لایه ظرفیت یا VSEPR برای تعیین شکل ملکولی بایستی شکلی تعیین شود که آن شکل حداقل دافعه الکترونی را داشته باشد.با به کار گیری این قاعده برای اتم کربن میتوان ملاحظه کرد که مثلا متان باید شکلی چهار وجهی و یا تتراهدرال داشته باشد و قرار گرفتن چهار پیوند به طرف گوشه های یک تتراهدرال بهترین ترتیب برای به حداقل رساندن دافعه الکترونی است.
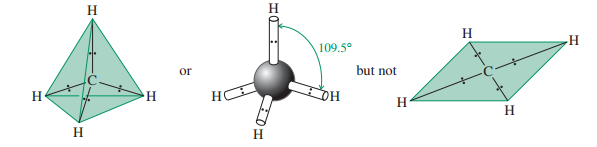
البته این ساختار تتراهدرال درصورتی صادق است که کربن چهار پیوند یگانه داشته باشد در غیر این صورت با توجه به نظریه دافعه جفت الکترون لایه ظرفیت میتواند درملکولهایی با شکل های متفاوت قرار گیرد.مثلا در کربن منواکسید شکلی خطی دارد.
برای برسی ویژگی های دیگر اتم کربن در ملکول ها همراه ما باشید…
[/vc_column_text][/vc_column][/vc_row][vc_row][vc_column width=”1/3″][/vc_column][vc_column width=”1/3″][tlg_button title=”از ما حمایت کنید .” btn_link=”url:https%3A%2F%2Fidpay.ir%2Fshimidoon|||” btn_size=”btn-block” layout=”btn btn-filled btn-light btn-rounded” hover=”hvr-pop” icon=”ti-money” button_icon_hover=”yes” css_animation=”fadeIn” customize_button=”yes” btn_custom_layout=”btn btn-rounded” btn_color=”#ffffff” btn_bg_gradient=”#870501″ btn_bg_gradient_hover=”#eded00″ btn_bg_hover=”#d80700″ btn_border_hover=”#43c100″ btn_bg=”#1e0000″][/vc_column][vc_column width=”1/3″][/vc_column][/vc_row]