پیوندهای شیمیایی (پیوند فلزی)
درحالی که پیوندهای یونی، بین اتم های فلز و نافلز و پیوندهای کووالانسی، بین اتم های نافلزی برقرار می شوند؛ پیوندهای فلزی، سبب ایجاد اتصال، بین اتم های فلز می گردند.
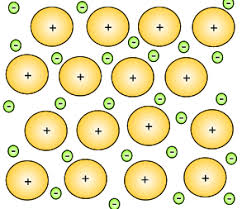
درواقع چون سطح انرژی لایه های الکترونی خارجی اتم های فلز (اوربیتال های s و p) با هم همپوشانی دارند؛ هنگام رسیدن چنین اتم هایی به پایداری، حداقل یکی از الکترون های ظرفیت آن ها، در پیوند بین اتم ها شرکت می کند اما نه به گونه ای که با اتم/ اتم های دیگر درگیر پیوند، به اشتراک گذاشته شود و یا برای تشکیل یون از بین رود؛ بلکه اینگونه الکترون ها فضایی را تشکیل می دهند که، گاها از آن تحت عنوان “دریای الکترون” یاد می شود و بدین ترتیب، سبب حرکت آزادانه ی الکترون های ظرفیت از یک اتم به اتم دیگر می گردد.
پس به بیانی بهتر و خلاصه تر خواهی داشت:
پیوند فلزی، نیروی جاذبهای است که از تأثیر متقابل الکترونهای غیر مستقر (یعنی همان الکترونهای لایهی ظرفیت) و ذرههای مثبت (هسته ی اتم ها که دارای بار مثبت هستند) شبکهی بلوری فلز، به وجود میآید.
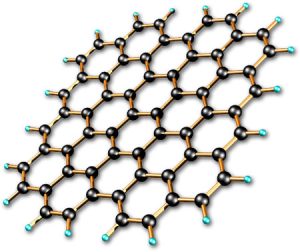
به عنوان مثالی از پیوندهای فلزی می توان به گرافن (آلوتروپ کربن) اشاره کرد که یک پیوند فلزی دو بعدی است.
خصوصیات پیوندهای فلزی
رسانایی الکتریکی
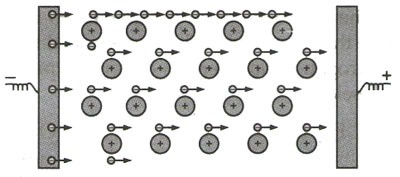
رسانایی الکتریکی اصطلاحی است که، برای بیان توانایی یک ماده در عبور دادن جریان الکتریکی از خودش، استفاده می شود. از آنجا که الکترون ها در دریای الکترون، تحت تاثیر هسته ی مشخصی نیستند؛ بنابراین حرکت شان دارای محدودیت نبوده و هنگامی که یک اختلاف پتانسیل به فلز وارد شود، الکترون های گفته شده شروع به حرکت به سمت بار مثبت کرده و سبب برقراری جریان الکتریکی درون فلز می گردند؛ به همین علت، فلزات رسانای خوبی برای جریان الکتریکی می باشند.
رسانایی گرمایی
به دلیل پیوندهای فلزی، الکترون ها بسیار متحرک بوده؛ بنابراین هنگامی که قسمتی از یک ماده ی فلزی گرم می شود، انرژی جنبشی الکترون های آن منطقه ، افزایش می یابد. این الکترون ها از طریق برخورد، انرژی جنبشی خود را به سایر الکترون های دریا منتقل می کنند و هرچه تحرک الکترون ها بیشتر باشد، انتقال انرژی جنبشی سریع تر اتفاق می افتد؛ به همین علت فلزات، رسانای خوبی برای انرژی گرمایی می باشند.
قابلیت انعطاف پذیری و شکل پذیری
هنگام وارد شدن ضربه به فلزات با ابزاری نظیر چکش، دریای الکترون ها در پیوند فلزی، تغییر شکل شبکه را امکان پذیر کرده؛ بنابراین شبکه ی سفت و سخت، تغییر شکل یافته و شکسته نمی شود.
به همین علت است که می توان فلزات را به صورت ورقه های نازک در آورد و از آنجا که این شبکه ها به راحتی نمی شکنند، گفته می شود که فلزات بسیار شکل پذیر هستند؛ مانند فویل آلومینیوم که یک ورقه نازک متشکل از پیوندهای فلزی است.
براقیت
هنگامی که نور بر یک سطح فلزی می تابد، انرژی نور تابیده شده، توسط دریای الکترون هایی که پیوند فلزی را تشکیل می دهند، جذب می شود؛ این جذب انرژی باعث تحریک الکترون ها و افزایش سطح انرژی آن ها شده و اصطلاحا الکترون ها برانگیحته می شوند؛ که پایداری آن ها را کاهش می دهد، بنابراین الکترون ها تمایل داشته که به حالت پایدار اولیه ی خود برگردند و در این مرحله، با آزاد کردن انرژی جذب شده، نور ساطع می کنند. این تابش نور در اثر تحریک الکترون ها، سبب درخشندگی فلزات می گردد.
نقاط ذوب و جوش بالا
نیروی جاذبه ی بین اتم های فلزی، بسیار قوی بوده و برای غلبه بر این نیروی جاذبه، انرژی زیادی لازم است؛ به همین دلیل فلزات دارای نقطه ذوب و جوش بالایی هستند و موارد استثنا در این مورد شامل روی، کادمیوم و جیوه می باشد.