پیوندهای شیمیایی (پیوند کووالانسی 2)
در مقالات گذشته به تعریف پیوند شیمیایی و انواع آن پرداختیم و درنهایت به دسته بندی پیوند کوالانسی رسیدیم که در این مقاله هدف بررسی سایر دسته بندی ها و ویژگی های پیوند کووالانسی می باشد:
انواع پیوندهای کووالانسی از نظر قدرت پیوند
1. پیوند کووالانسی غیرقطبی
2. پیوند کووالانسی قطبی
1. پیوند کووالانسی غیرقطبی
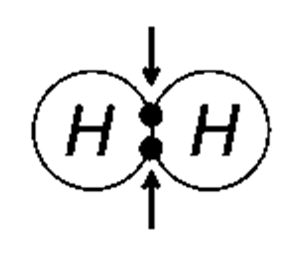
پیوند کووالانسی غیر قطبی زمانی ایجاد می گردد که الکترون های به اشتراک گذاشته شده، بطور برابر بین اتم های درگیر پیوند، تقسیم شده باشند؛ که این الکترون های مشترک، دو اتم را به یکدیگر پیوند داده و یک مولکول را تشکیل می دهند.
مثالی از پیوند کووالانسی غیر قطبی پیوند بین دو اتم هیدروژن یا دو اتم کلر می باشد؛ زیرا الکترون ها بطور مساوی بین دو اتم های درگیر پیوند تقسیم شده اند.
پیوند کووالانسی قطبی
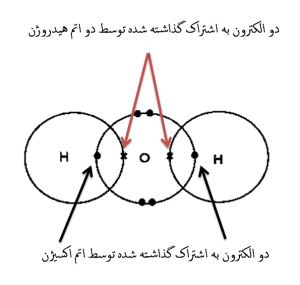
پیوند کووالانسی قطبی زمانی ایجاد می گردد که الکترون های به اشتراک گذاشته شده، بطور نابرابر بین اتم های درگیر پیوند، تقسیم شده باشند؛ درواقع در این نوع پیوند اتم الکترونگاتیوتر، تاثیر بیشتری روی الکترون های پیوندی داشته و نسبت به اتم/اتم های دیگر، الکترون های پیوندی را بیشتر به خود جذب می کند؛ بنابراین باتوجه به منفی بودن بار الکتریکی الکترون، وقتی الکترون ها بیشتر جذب یک اتم گردند یا به تعبیری زمان بیشتری را با یک اتم سپری کنند، باعث شده که آن اتم، بار منفی جزئی پیدا کرده و اتمی که جاذبه ی کمتری روی الکترون ها دارد یا به تعبیری زمان زیادی را با الکترون سپری نمی کند، بار مثبت جزئی را پیدا کند.
مثالی از پیوند کووالانسی قطبی، پیوند بین اتم ها، در مولکول آب می باشد؛ در این پیوند که حاصل اشتراک دو الکترون از اتم اکسیژن و دو الکترون از دو اتم هیدروژن می باشد؛ اتم اکسیژن نسبت به دو اتم هیدروژن، تمایل بیشتری در جذب الکترون های پیوندی داشته؛ بنابراین بارمنفی جزئی پیدا کرده و دو اتم هیدروژن که تمایل کمتری در جذب الکترون های پیوندی دارند، بار مثبت جزئی پیدا می کنند.
پیوند کووالانسی ازنظر تعداد دفعات تشکیل پیوند
گاهی اوقات بعضی عناصر پیوند کووالانسی را بارها و بارها در یک ماده تشکیل می دهند و این امر منجر به پیدایش ساختاری شده که دائما تکرار می شود و مولکول های بسیار بزرگی را تشکیل می دهد؛ که در این حالت از پیوندهای تشکیل شده تحت عنوان پیوند کووالانسی شبکه یاد می شود.
بعنوان مثال می توان ساختار الماس را درنظر گرفت؛ که هر اتم کربن توسط چهار پیوند کووالانسی به چهار اتم کربن دیگر متصل شده و این امر، برای تمام اتم های کربن موجود در ساختار الماس برقرار است و سبب تشکیل یک مولکول بزرگ به نام کریستال الماس می گردد.
سیلیکات هایی که در کوارتز، ماسه و بسیاری از مواد معدنی دیگر یافت می شوند نیز، توسط پیوند کووالانسی شبکه به یکدیگر متصل شده اند.
ویژگی های پیوند کووالانسی
1. پیوند کووالانسی منجر به تشکیل فرم جدیدی از الکترون ها نمی شود بلکه این پیوند، فقط الکترون ها را جفت می کند.
2. پیوند کووالانسی به طور معمول حاوی انرژی حدود ~ 80 کیلو کالری در هر مول (کیلو کالری در مول) است.
3. پیوندهای کووالانسی پس از تشکیل، به ندرت بطور خود به خود از بین می روند.
4. پیوندهای کووالانسی به گونه ای هستند، که اتم های درگیر پیوند، برای دستیابی به پایداری، پس از اشتراک الکترون، جهت گیری های خاصی را نسبت به یکدیگر نشان می دهند.
5. اکثر ترکیبات دارای پیوند کووالانسی از نقطه ی ذوب و جوش نسبتاً کمی برخوردار هستند.
6. ترکیبی که با پیوند کووالانسی تشکیل می شود، به دلیل کمبود الکترون آزاد، جریان الکتریکی را به خوبی هدایت نمی کند.
7. اکثر ترکیبات کووالانسی در آب محلول نیستند.
8. ترکیبات دارای پیوند کووالانسی در دمای اتاق به حالت مایع یا گازی هستند؛ مانند متان، اسید هیدروکلریک و…