پیوندهای شیمیایی
هنگامی که فیزیکدانان در مطالعه ی ساختار اتم، دریافتند که الکترون های اطراف هسته آرایش خاصی دارند، شیمی دانان شروع به تحقیق در مورد چگونگی مطابقت این نظریه ها با شیمی شناخته شده عناصر و ارتباط بین اتم های سازنده ی آن ها کرده و در سال 1916، گیلبرت نیوتون لوئیس، مقاله ای منتشر کرد که در آن، پیوند شیمیایی را، یک جفت الکترون که توسط دو اتم تقسیم شده است، تعریف کرد.

امروزه، به هرگونه فعل و انفعال مربوط به ارتباط اتم ها با مولکول ها، یون ها، کریستال ها و سایر گونه های پایداری که مواد شناخته شده ی دنیای ما را تشکیل می دهند، پیوند شیمیایی گویند.
به بیانی دیگر، هر اتم متناسب با الکترون های ظرفیت(1) خود، یک توانایی نسبی در جذب الکترون های ظرفیت اتم های دیگر را داراست(2)؛ بنابراین، زمانیکه اتم ها به یکدیگر نزدیک می شوند، تمایل داشته در فضا به گونه ای آرایش یابند، که انرژی کل آن ها، کمتر از انرژی هر نوع آرایش دیگری باشد؛ بنابراین هسته ها و الکترون های ظرفیت آنها با یکدیگر واکنش داده، هم پوشانی بین ابر الکترونی لایه ی ظرفیت آن ها صورت گرفته و اگر انرژی کل این گروه از اتم ها، از مجموع انرژی تکی اتم ها، کمتر باشد، اتم ها با یکدیگر، ارتباطی تحت عنوان پیوند شیمیایی برقرار می کنند.
به انرژی آزاد شده در این فرآیند (یعنی رسیدن اتم ها به پایداری) ، انرژی پیوند گفته شده و هرچه این انرژی آزاد شده بیشتر باشد، ترکیب حاصل، پایدارتر خواهد بود.
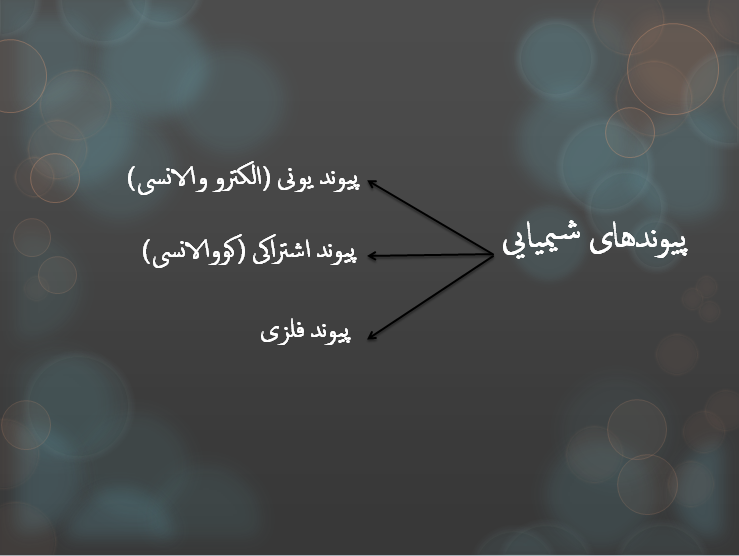
پیوندهای شیمیایی مطابق شکل زیر دسته بندی می گردند:
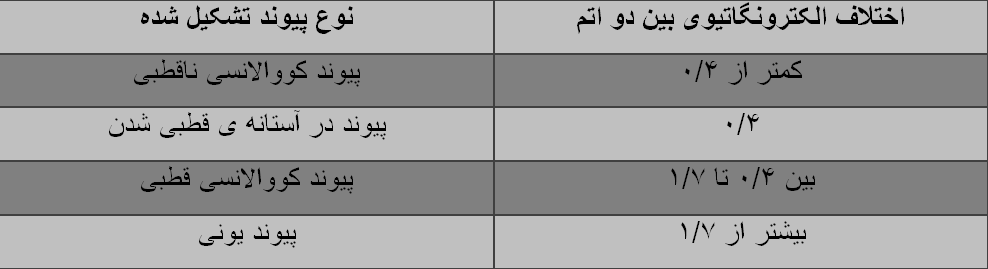
قدرت یا میزان قطبی بودن یک پیوند، توسط اختلاف الکترونگاتیوی اتم های درگیر در آن پیوند، تعیین می شود؛ هرچه اختلاف الکترونگاتیوی بین دو اتم بیشتر باشد، میزان قطبی بودن پیوند یا به بیانی دیگر خصلت یونی پیوندی که تشکیل می شود، بیشتر خواهد بود.
برای درک بهتر این اختلافات، جدولی به شرح زیر خواهیم داشت:
لازم به ذکر است که طبق جدول تناوبی عناصر، در یک ردیف، از چپ به راست، الکترونگاتیوی افزایش و در یک گروه از بالا به پائین، کاهش می یابد؛ در شکل زیر، مقادیر الکترونگاتیوی عناصر مختلف را مشاهده می کنید:
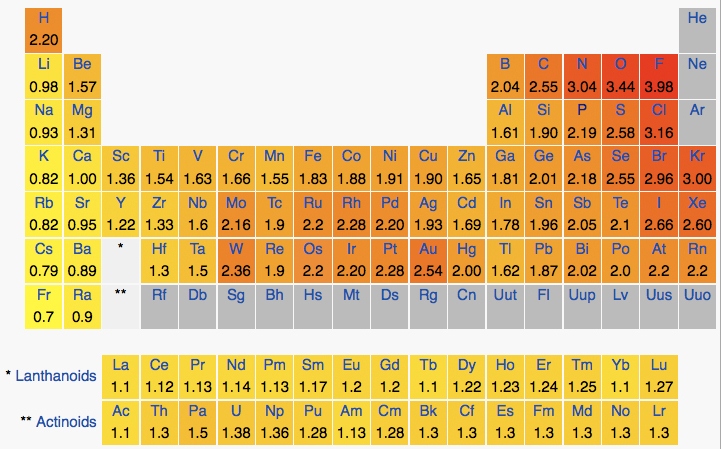
در ادامه به بررسی دسته ی اول پیوند های شیمیایی، یعنی پیوندهای یونی می پردازیم؛ بنابراین برای ورود به بحث، تعریف چند اصطلاح را به شرح زیر خواهیم داشت:
یون چیست؟
هنگامیکه اتم ها، برای رسیدن به پایداری بیشتر، الکترون از دست داده یا دریافت می کنند، تبدیل به ذرات بارداری به نام یون می شوند.
انواع یون از نظر نوع بار
کاتیون: اتمی که یک یا چند الکترون ظرفیت خود را از دست داده و به یونی با بار مثبت تبدیل می شود، به عنوان کاتیون شناخته می شود.
آنیون: اتمی که الکترون بدست آورده و به یونی با بار منفی تبدیل می شود، به عنوان آنیون شناخته می شود.
انواع یون از نظر تعداد اتم
یون تک اتمی:
کاتیون یا آنیونی که تنها از یک اتم تشکیل شده باشد را یون تک اتمی گویند. عناصر جدول تناوبی، همگی دارای یون تک اتمی بوده و در این بین برخی عناصر مانند کروم، منگنز، آهن، کبالت، مس، قلع و… دارای بیش از یک یون تک اتمی می باشند.
یون چند اتمی:
کاتیون یا آنیونی که از چند اتم یکسان یا متفاوت، تشکیل شده باشد را، یون چند اتمی گویند؛ درواقع در این یون ها، بین اتم ها پیوند کووالانسی برقرار بوده و هنگام شرکت در واکنش ها، در کنار یکدیگر، مانند یک واحد مستقل عمل می کنند و بار الکتریکی در این یون ها، به کل مجموعه ی اتم تعلق دارد نه اتم خاصی از مجموعه.
بعنوان مثالی از یون های چند اتمی می توان یون نیترات، یون سولفات، یون کربنات و… اشاره کرد.
پیوند یونی
تبادل الکترون بین اتم ها، به دلیل ایجاد یون، منجر به جذب الکترواستاتیکی بین آن ها شده و آن ها را به یکدیگر متصل می کند که به این اتصال، پیوند یونی گفته شده و ترکیب حاصل از این پیوند را، ترکیب یونی گویند.
تعیین فرمول یک ترکیب یونی
برای تعیین فرمول شیمیایی ترکیبات یونی، دو شرط زیر باید رعایت شود:
1. هر یون، برای حداکثر پایداری، باید از قاعده ی اکتت(3) پیروی کند.
2. یون ها به گونه ای ترکیب می شوند، که ترکیب یونی حاصل، بطور کلی خنثی باشد؛ به عبارت دیگر، بار یون ها باید متعادل شوند.
برای ایجاد درکی بهتر، از فرمول یک ترکیب یونی، مثالی به شرح زیر خواهیم داشت:
یون منیزیم با فلوئور واکنش داده و ترکیبی یونی تشکیل می دهند، فرمول ترکیب چیست؟
منیزیم، در لایه ی ظرفیت خود، دارای دو الکترون بوده؛ بنابراین هنگام تبادل الکترون برای رسیدن به حداکثر پایداری (یعنی آرایش گاز نجیب) این دو الکترون را به راحتی از دست داده و یونی با دو بار مثبت تشکیل می دهد.
از طرفی فلوئور، برای رسیدن به پایداری (یعنی آرایش گاز نجیب) یک الکترون در لایه ی ظرفیت خود کم دارد، بنابراین هنگام مبادله ی الکترون، این تک الکترون را اتم های دیگر دریافت کرده و به یونی با یک بار منفی تبدیل می شود.
زمانیکه واکنش شیمیایی بین منیزیم و فلوئور صورت می گیرد، هر اتم منیزیم دو الکترون آزاد کرده و بنابراین دو اتم فلوئور را درگیر می کند یا به بیانی دیگر، به دو اتم فلوئور الکترون می دهد (چون هر اتم فلوئور به یک الکترون نیاز دارد)؛ در نتیجه ترکیب حاصل از واکنش بین اتم های عناصر منیزیم و فلوئور، دارای یک اتم منیزیم و دو اتم فلوئور می باشد؛ که فرمول این ترکیب را بصورت (MgF2) نمایش می دهند.
ویژگی های ترکیبات یونی
در مقیاس ماکروسکوپی؛ ترکیبات یونی، ساختارهای شبکه ای متبلوری را دارا هستند که هنگام ذوب شدن یا محلول شدن، باید این ساختار شبکه ای دچار فروپاشی شود، بنابراین این ترکیبات، دارای نقاط ذوب و جوش زیاد بوده و از طرفی چون این شبکه هنگام فروپاشی به یون های سازنده اش تفکیک می شود، محلول این ترکیبات، هدایت الکتریکی خوبی را از خود نشان می دهد.
1. الکترون هایی که در خارجی ترین پوسته ی یک اتم قرار دارند.
2. به توانایی نسبی اتم ها در کشیدن الکترون های اتم های دیگر به سمت خود، الکترونگاتیوی گویند.
3. قاعده ی هشت تایی یا اوکتت، معیاری برای سنجش میزان واکنش پذیری اتم ها براساس تمایل آن ها، برای رسیدن به آرایش الکترونی گازهای نجیب می باشد.