شیمی آلی
«بسم الله الرحمن الرحیم»
« سلام دوست عزیز» درخدمت شما هستم با مباحث گرم وگیرای شیمی آلی که بصورت خلاصه وسعی شده که بهترین مطالب و به شیوه ی کاملا راحت یا عامیانه در اختیارت قرار بدم.
اول بزار مطلب شیمی آلی رو بازکنم.مواد شیمیایی در تمام اطراف ما هستن مثلRNA , DNA , پروتیین , چیزایی که میخوریم و… مواد شیمیایی آلی اند. کربن(C) عنصریه که حیات بر اساس اون قرار داره . شیمی آلی مطالعه شیمی کربن و ترکیبات اونه.
در سال 1816مایکل شورول کسی بود که صابون رو کشف کرد یعنی فهمید اگه قلیا با چربی حیوانی واکنش بده میشه صابون. و صابون قابل تفکیک به یه سری ترکیبات هست که اسمشو اسید چرب گذاشت.
گلیسیرین+صابون→چربی حیوانی
اسید چرب→صابون
چربی حیوانی درحضور H2O وNaOH صابون و گلیسیرین تبدیل میشه و صابون در حضور H3Oتبدیل به اسید چرب میشه.
کشف بعدی شیمی آلی در سال 1828اتفاق افتاد .فریدریک و وهلر اوره را از واکنش آمونیوم سیانات در حضور آب و آمونیاک بدست اوردن.
NH4OCN→ N2H4CO
گفتیم که شیمی علم مطالعه کربنه اما چرا?
« چون کربن تنها عنصریه که تمایل به پیوند با خودش و تشکیل زنجیره های طویل یا حلقه هارو داره.»
مثل متان که کوچکترین و DNA بزرگترینه.امیدوارم مطالب ابتدایی جا افتاده باشه.
انواع پیوند:
سه نوع پیوند:
یونی، کووالانسی و فلزی.
پیوند یونی:
با انتقال الکترون از عنصر الکترو پوزیتیو(فلز) به عنصر الکترونگاتیو(غیر فلز) انجام میشه و به آرایش گاز نادر میرسه.
مثال: NaCl، KBrو NaFو… ترکیبات یونی جامداند و دمای ذوبشون بالاست و در شبکه بلوری یون ها نقاط کاملا معینی را اشغال میکنند.
پیوند کووالانت:
عناصر میانی جدول تناوبی الکترون به اشتراک میگذارن و پیوند کووالانتی تشکیل می دهند.(لوویس)
ساختمان های لوویس الکترون های قشر خارجی اتم را به صورت نقطه هایی نشان میدهند.هیدروژن با یک نقطه(1S)کربن با 4 نقطه(2p٢،2s٢) واکسیژن با 6 نقطه(3s٢3p۴) نشان داده می شود. وقتی مولکول پایداره که تمام اتم ها آرایش گاز نادر داشته باشند.
نکته :ساختمان لوویس از این نظر که الکترون های قشر آخر(الکترون های والانس) را نشان می دهد دارای ارزش است.
روش ساده تربرای نشان دادن پیوند ساختمان ککوله است که به آن پیوند خطی میگن.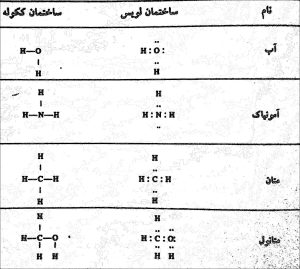
ساده ترین نوع پیوند کووالانسی در مولکول های دواتمیه، مثل H2, F2, Cl2, Br2 که در آنها دانسیته الکترونی به طور یکسان بین دواتم توزیع شده. ولی اگر الکترونگاتیوی اتم ها نابرابر باشه، جفت الکترون به اتم الکترونگاتیو نزدیکتره و دانسیته الکترونی در سمت اتم الکترونگاتیو متراکم تر و بیش تره. درنتیجه پیوند کووالانسی قطبی است. مثل HCl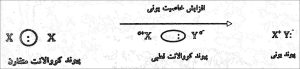
واکنشی که طی آن یک پیوند دو الکترونی گسسته می شه پس از گسسته شدن هر جزء آن 1 الکترون داره واکنش گسسته شدن ((جور یا همولیز)) می نامند.![]()
انرژی لازم برای گسسته شدن پیوند را انرژی تفکیک پیوند می نامند برحسب Kcal / mol است.
واکنشی که در آن هر2 الکترون پیوند به همراه یکی از اجزاء می رود گسَته شدن ناجور یا هترولیز می نامند.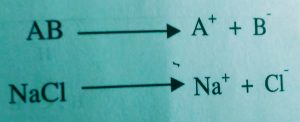
نکته: درفاز گازی تفکیک پیوند از طریق (همولیز) صورت می گیره و در حلال های یونی معمولا(هترولیز) ارجحیت داره.