کاتالیزور ها و دنیای شیمی
در علم شیمی، سرعت واکنش ها و نیز مکانیسم هر یک از آن ها مورد بررسی قرار می گیرد. هر واکنش، بسته به شرایطی که در آن قرار می گیرد، می تواند بسیار آهسته و یا بسیار سریع انجام شود. به عنوان مثال، زنگ زدن آهن را در نظر بگیرید.
همه ما می دانیم که این یک واکنش شیمیایی بسیار آهسته است. اما ما می توانیم شرایطی را فراهم کنیم، تا همین واکنش با سرعت بسیار بیشتری انجام شود. مثلا اگر دما و رطوبت محیط را افزایش دهیم، سرعت واکنش بیشتر می شود. و اگر دمای هوا را کم کرده و رطوبت را کاهش دهیم، سرعت واکنش نیز کم می شود.
هر واکنشی با سرعت مشخصی رخ می دهد و با تغییر در شرایط واکنش، می توان سرعت انجام آن را تا حدی کنترل کرد. اما برای برخی فرآیند های خاص، تغییر شرایط واکنش، تاثیر چندانی در سرعت آن ندارد. مثلا، از واکنش بین نیتروژن و هیدروژن، آمونیاک تولید می شود.
در شرایط محیطی عادی (مثلا در اتاق شما) سرعت این واکنش به حدی پایین است که می توانم بگویم تقریبا هیچ واکنشی انجام نمی شود. حال اگر شرایط محیطی را عوض کنیم چطور؟ مثلا، دمای محیط را بالا ببریم و… باز هم سرعت این واکنش به حدی پایین است که تقریبا انجام نمی شود.
در مورد چنین واکنش هایی، ما از موادی به نام کاتالیست استفاده می کنیم. این مواد، ضمن انجام یک واکنش معین، بدون آن که مصرف شوند، سرعت واکنش را افزایش می دهند. به عنوان مثال، در همین واکنش تهیه آمونیاک، اگر از کاتالیزور استفاده نشود؛ تقریبا هیچ واکنشی رخ نمی دهد.
اما در حضور کاتالیست و البته در دما و فشار زیاد، سرعت این واکنش به حدی است که می توان از آن به صورت صنعتی استفاده کرد.
یک کاتالیزور چگونه کار می کند؟
برای هر واکنشی که رخ می دهد، یک نمودار انرژی بر حسب پیشرفت واکنش وجود دارد. در این نمودار که شکل آن را در تصویر زیر مشاهده می کنید، واکنش دهنده ها با دریافت انرژی به اندازه انرژی فعال سازی، به پیچیده فعال (transition state) تبدیل می شوند. این حالت، یک حالت بینابینی بوده و بسیار ناپایدار است.

سپس پیچیده فعال تجزیه شده و به محصولات واکنش تبدیل می شود. اختلاف سطح انرژی واکنش دهنده ها و پیچیده فعال را تحت عنوان مفهومی به نام انرژی فعال سازی می شناسیم. یک کاتالیست، صرفا بر اندازه این انرژی اثر می گذارد و واکنش را از مسیری پیش می برد که انرژی فعال سازی کمتری داشته باشد.
واکنش را از مسیر دیگری پیش می برد یعنی چه؟
فرض کنید که برای انجام یک واکنش معین، می بایست که برخورد هایی با انرژی کافی و در جهت صحیح بین واکنش دهنده ها رخ دهد. در این حالت، آنتالپی واکنش مقدار مشخصی دارد. حال فرض کنید که مولکول های واکنش دهنده، مولکول های آلی بزرگی باشند که صرفا باید از جهت خاصی به هم برخورد کنند تا واکنش رخ دهد. به نظر تان به ازای هر چند برخورد، یک برخورد موفق به انجام واکنش می شود؟
حال اگر از یک کاتالیست استفاده کنیم که یکی از این مواد را بر روی خودش جذب سطحی کند و در جهت صحیح برای برخورد قرار دهد چه اتفاقی می افتد؟ هر برخورد مولکول دوم با این مجموعه (کاتالیزور و مولکول واکنش دهنده اول جذب شده روی آن) منجر به واکنش می شود. بنابراین واکنش از مسیر دیگری پیش رفته و سرعت آن نیز افزایش یافته است.
این کاری است که یک کاتالیست انجام می دهد: مسیر انجام واکنش را عوض می کند تا انرژی فعال سازی مورد نیاز برای انجام واکنش را عوض کند.
تصویر زیر، توضیحات ما را کامل می کند؛ به همه جزئیات آن توجه کنید. نمودار A حالت بدون کاتالیزور را نمایش می دهد و در نمودار B از یک کاتالیزور مناسب استفاده شده است.
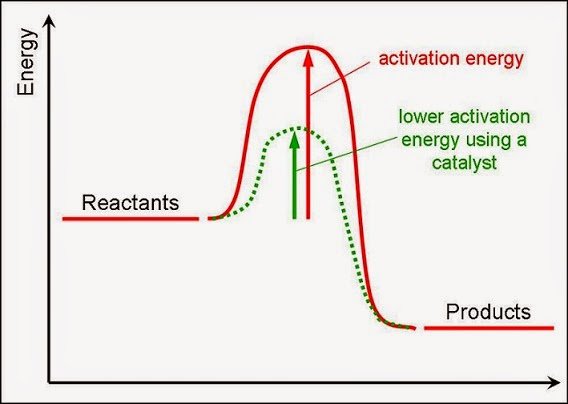
همانطور که مشاهده می کنید، میزان آنتالپی هر دو حالت یکسان است. اما انرژی فعال سازی آن ها تفاوت چشمگیری را نشان می دهد. نمودار سبز رنگ که استفاده از کاتالیزور را نشان می دهد با صرف انرژی فعال سازی بسیار کمتری منجر به ایجاد همان محصول شده است.
به این پست چند تا ستاره میدی؟
برای امتیاز دهی روی ستاره ها کلیک کن
امتیاز میانگین 4 / 5. تعداد رای ها 1









