برای پرداختن به این سوال که هیبریداسیون چیست، ابتدا باید به این پرسش بپردازیم که پیوند های شیمیایی چگونه ایجاد می شوند؟
همه ما می دانیم که ساده ترین مدلی که از ایجاد پیوند های شیمیایی در اختیار داریم مربوط به چیزهایی است که در دبیرستان آموخته ایم. در آن جا برای شکل گیری چند نوع مختلف پیوند، روش های گوناگونی مطرح کرده بودند. اما همه آن ها در یک مطلب اشتراک داشتند؛ آن نکته مشترک، اشتراک گذاری الکترون های لایه والانس (لایه ظرفیت) بین دو اتم درگیر در در پیوند است.
حال این به اشتراک گذاری می توانست به سه شکل مختلف انجام شود:
اگر هر اتم یک الکترون لایه والانس خود را برای اشتراک گذاری بیاورد، پیوند از نوع کوالانسی خواهد بود.
اگر یکی از اتم ها دو الکترون مورد نیاز را بیاورد و اتم دیگر هیچ الکترونی نیاورد، پیوند از نوع کوالانسی کئوردینانسی (داتیو) خواهد بود.
اگر دو اتم به یون تبدیل شده باشند. یکی از اتم ها به صورت یون منفی و دیگری به صورت یون مثبت، وارد پیوند یونی خواهند شد.
این ها گذاره های اشتباهی نیستند اما همه حقایق را بیان نمی کنند. محققین بعدی، به توسعه این نظریه ها پرداختند و برخی دیگر نیز به ارائه مدل های جدید پرداختند. مدل هایی که توضیحات دقیق تری ارائه می کردند و پدیده های بیشتری را توجیه می کردند.
یکی از این نظریات، نظریه هیبریداسیون است. اما نظریه هیبریداسیون چیست و پیوند های شیمیایی را چگونه توجیه می کند؟ برای پاسخ به این پرسش ها ابتدا باید به سراغ مبانی این نظریه بپردازیم.
مبانی نظریه هیبریداسیون
برای درک نظریه هیبریداسیون ابتدا باید به سراغ مکانیک کوانتومی برویم. بر اساس آن چه از توضیحات مکانیک کوانتومی بر می آید. الکترون های موجود در ساختار اتم ها به صورت لایه ای در اطراف هسته قرار گرفته اند. هر یک از این لایه ها حاوی تعدادی زیر لایه بوده و هر زیر لایه دارای یک یا چند اوربیتال می باشد که هر اوربیتال می تواند میزبان 2 الکترون باشد.
آن چه از حل معادله شرودینگر به دست می آید، تعدادی اوربیتال s و p و d و f می باشد که هر یک از آن ها شکل منحصر به فرد خود را دارد. در شکل زیر برخی از آن ها را مشاهده می کنید.
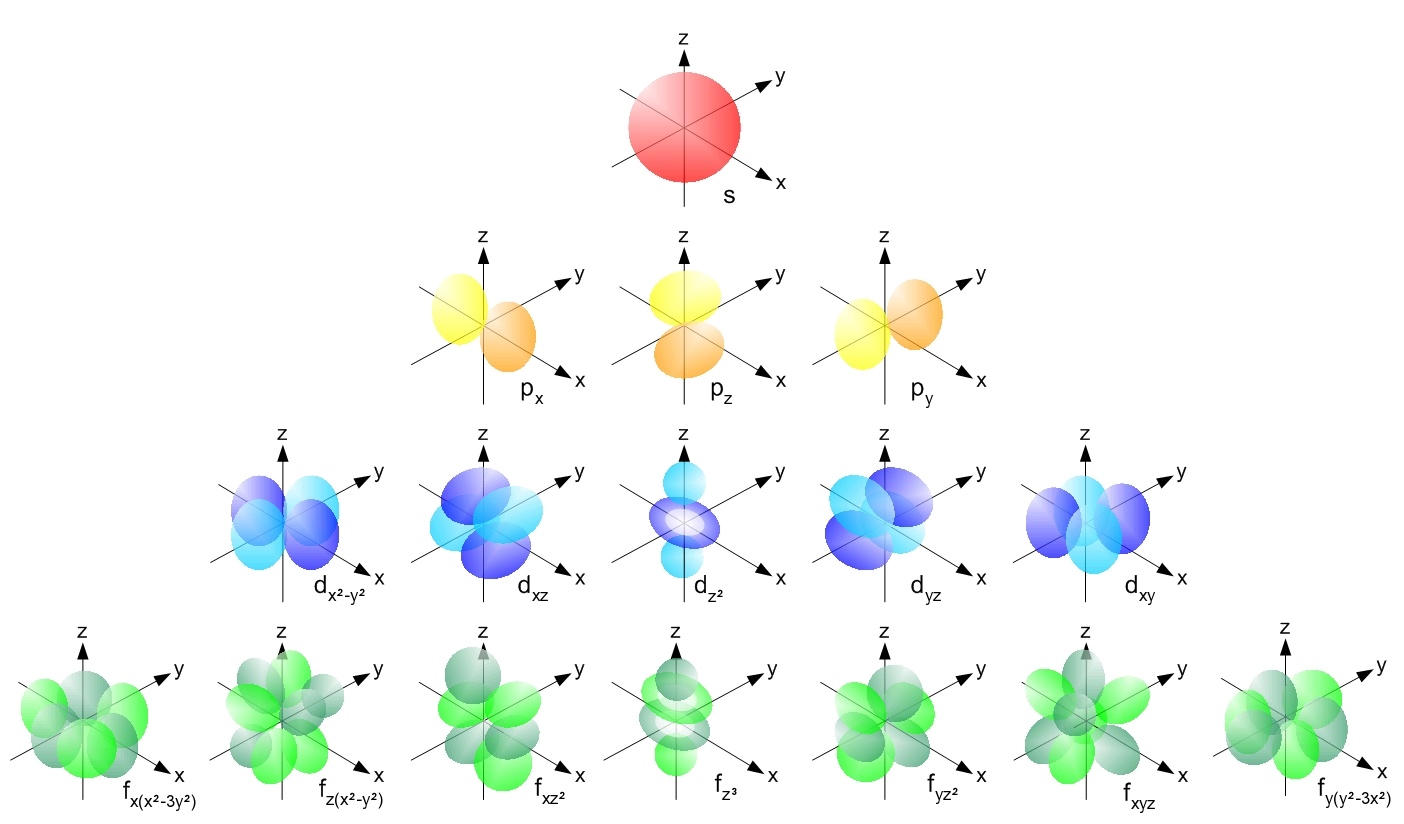
نمایی از اوربیتال های مولکولی
برای ایجاد پیوند های شیمیایی، این اوربیتال های اتمی دو اتم، تغییر شکل داده و در قالب یک اوربیتال واحد به نام اوربیتال مولکولی در می آیند. بر اساس نظریه هیبریداسیون، در برخی موارد که لازم است (در ادامه توضیح می دهیم)، اوربیتال های اتمی، ابتدا به اوربیتال های جدیدی به نام اوربیتال های هیبریدی تبدیل می شود و سپس در مجاورت اوربیتال های اتم دیگر به اوربیتال های مولکولی تبدیل می شوند.
اما این برخی موارد لازم چه مواردی هستند؟
به عنوان مثال، فرض کنید یک اتم کربن بخواهد با یک اتم هیدروژن پیوند ایجاد کند. ساختار الکترونی کربن به صورت زیر خواهد بود:
ساختار الکترونی کربن قبل پیوند
اگر هیدروژن به کربن نزدیک شود و بخواهد با آن پیوند ایجاد کند، یک الکترون موجود در هیدروژن وارد یکی از اوربیتال های نیمه پر 2p کربن می شود و پیوند برقرار می شود. بنابراین، با این حساب، تنها می توان برای هر کربن، دو پیوند در نظر گرفت (نه بیشتر). به تصویر زیر که برقراری چنین پیوندی را نشان می دهد توجه کنید.
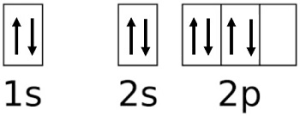
ساختار الکترونی کربن بعد پیوند
اما ما می دانیم که اتم های کربن موجود در طبیعت می توانند تا 4 پیوند برقرار کنند(مثل متان ). اما این چگونه توجیه پذیر است؟ اینجاست که نظریه هیبریداسیون به کمک می آید و این پدیده را توضیح می دهد.
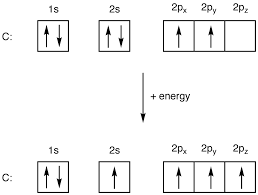
بر اساس نظریه هیبریداسیون، اوربیتال های اتم کربن، پیش از برقراری پیوند در قالب اوربیتال های هیبریدی تغییر شکل می دهند و سپس این اوربیتال های هیبریدی هستند که پیوند ها را ایجاد می کنند. اما چگونه این اتفاق رخ می دهد؟ همانطور که می دانیم، در حالت عادی، ساختار الکترونی کربن به صورت زیر است:
نظریه هیبریداسیون بیان می کند که این ساختار الکترونی با دریافت انرژی تغییر شکل داده و به صورت زیر در می آید:
در این صورت، یک الکترون جفت شده در اوربیتال 2s به اوربیتال خالی موجود در 2p منتقل شده و آن را تک الکترونی می کند. در نتیجه آن، چهار اوربیتال تک الکترونی به وجود می آید که امکان ایجاد 4 پیوند شیمیایی را فراهم می کند. نظریه هیبریداسیون همچنین می افزاید که اوربیتال های هیبریدی به وجود آمده اصلا همانند اوربیتال های اتمی اولیه نیستند؛ بلکه اوربیتال های جدید هستند که به آن ها اوربیتال های هیبریدی گفته می شود. هیبریدی که در بالا نشان داده شده است، به هیبرید معروف است.
این یعنی در ساخت چنین اوربیتال هیبریدی، یک اوربیتال s و سه اوربیتال p درگیر هستند. ساختار فضایی چنین روندی برای ایجاد اوربیتال هیبریدی را در شکل زیر مشاهده می کنید:

روند ایجاد اوربیتال هیبریدی sp3
این تنها مقدمه ای بر نظریه هیبریداسیون است. در مقالات بعدی به ادامه این بحث خواهیم پرداخت…
به این پست چند تا ستاره میدی؟
برای امتیاز دهی روی ستاره ها کلیک کن
امتیاز میانگین 5 / 5. تعداد رای ها 7