پیش از وارد شدن به بحث قانون فشار های جزئی دالتون لازم است تا درباره کسر مولی بیشتر بدانیم.
کسر مولی:
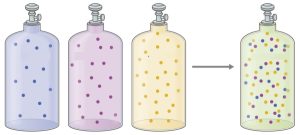
مفهوم کسر مولی را می توان با یک توضیح ساده به این صورت توضیح داد: فرض کنید 3 مول گاز هیدروژن و 2 مول گاز نیتروژن داشته باشیم. اگر بخواهیم این مخلوط گازی را درون یک سیلندر وارد کنیم و سپس یک بادکنک از آن گاز را پر کنیم؛ چه میزانی از نیتروژن و چه میزانی از هیدروژن درون بادکنک خواهد بود؟
قطعا به همان میزان مخلوط اولیه, یعنی 3/5 آن از هیدروژن و 2/5 آن از نیتروژن خواهد بود. حالا اگر به جای حجم از یک مول استفاده کنیم چطور؟ یعنی به جای اینکه از این سیلندر یک بادکنک گاز برداریم, یک مول گاز برداریم. آن موقع در آن یک مول چه میزانی از هیدروژن و چه میزانی از نیتروژن وجود دارد؟
در اینجا از مفهومی به نام کسر مولی استفاده می شود که برای ما مشخص می کند در یک مول از گاز یا مایعی که در اختیار داریم, چه میزانی از هر ماده وجود دارد. برای کسر مولی دو فرمول وجود دارد:
در این فرمول, na برابر با تعداد مول از ماده a و nT برابر با تعداد کل مول های مواد موجود است. می توان نوشت:
کسر مولی را با نماد χ نمایش می دهند (بخوانید کای). فرم دیگر معادله مربوط به کسر مولی در مخلوط های گازی استفاده می شود و داریم:
در این معادله Pa به معنی فشار جزئی گاز a و PT به معنی فشار کل است که از حاصل جمع فشار های جزئی گاز های سازنده مخلوط به دست می آید. توجه داشته باشید که حاصل جمع کسر های مولی همه مواد شرکت کننده در مخلوط باید برابر 1 باشد. در غیر این صورت محاسبات شما غلط دارد.
قانون فشار های جزئی دالتون:
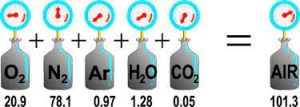
بنا به نظر دالتون, هر گاز در یک مخلوط گازی, قسمتی از فشار کل گاز را می سازد. به این معنی که اگر دو گاز الف و ب را داشته باشید؛ گاز الف میزان مشخصی فشار ایجاد می کند و گاز ب نیز به میزان مشخصی. اما وقتی با هم مخلوط می شوند, فشار کل برابر با حاصل جمع فشار هر یک از این هاست, زمانی که به تنهایی کل ظرف را پر کرده باشند. بنابراین داریم:
برای درک این موضوع به شکل زیر توجه کنید:
قانون فشار های جزئی دالتون استفاده های متعددی دارد اما یک قانون کاملا دقیق نیست؛ چون از برهمکنش بین ذرات گازی صرف نظر می کند و آن را در نظر نمی گیرد. برای مثال فرض کنید یک گازی داریم که مولکول های آن قطبی باشد. وقتی گاز دیگری وارد کنیم که مولکول های ناقطبی داشته باشد میزان برهمکنش بین این ذرات خیلی قابل توجه نیست و تقریبا از آن صرف نظر می شود اما اگر گاز دومی که وارد می شود نیز مانند گاز اول دارای مولکول های قطبی باشد, آنگاه نمی توان از برهمکنش بین آن ها صرف نظر کرد و بنابراین میزان فشار کل مخلوط از آن چه که در نظر داشتیم کمتر خواهد شد.
بنابراین گرچه معادله دالتون کاملا دقیق نیست اما کاملا هم غلط نیست و در برخی محاسبات که به دقت بالایی نیاز ندارد قابل استناد است.
به این پست چند تا ستاره میدی؟
برای امتیاز دهی روی ستاره ها کلیک کن
امتیاز میانگین 0 / 5. تعداد رای ها 0