
پیوندهای شیمیایی (پیوند کووالانسی)
همانطور که در مقاله ی گذشته مطرح شد، پیوند شیمیایی حاصل فعل و انفعال بین اتم ها، برای رسیدن به حالتی پایدار می باشد؛ به بیانی ساده تر، اتم ها برای رسیدن به پایداری:
1یا الکترون های ظرفیت خود را از دست می دهند؛
2یا الکترون های ظرفیت اتم های دیگر را دریافت می کنند ( به دست می آورند)؛
3 و یا الکترون های ظرفیت شان را به اشتراک می گذارند (تقسیم می کنند)؛
تا به سطح مشخصی از پایداری برسند؛ که از این سطح پایداری، تحت عنوان آرایش هشت تایی یاد می شود.
در پیوند یونی از دست دادن و یا دریافت الکترون ها مطرح بود؛ اما زمانی که اختلاف الکترونگاتیوی(1) بین دو اتم بسیار کم باشد، به قدری که باعث تبادل الکترون بین اتم ها یا به بیانی دیگر باعث ایجاد یون و پیوند یونی نگردد؛ هم پوشانی بین اوربیتال های(2) اتمی اتفاق افتاده، که در این فضا الکترون ها به اشتراک گذاشته می شوند، بنابراین:
پیوند کووالانسی، که پیوند اشتراکی یا مولکولی نیز نامیده می شود، از تقسیم الکترون بین دو یا چند اتم حاصل می گردد؛ که این الکترون های به اشتراک گذاشته شده بطور همزمان، توسط هسته ی اتم های درگیر پیوند، جذب می گردند و به آن ها، الکترون های اشتراکی یا الکترون های پیوندی گفته می شود.
لازم به ذکر است که پیوند کووالانسی، بیشتر بین فلزات یا بین دو عنصر یکسان (یا مشابه) اتفاق می افتد.
انواع پیوند کووالانسی از نظر تعداد الکترون به اشتراک گذاشته شده
1. پیوند کووالانسی یگانه
2. پیوند کووالانسی چندگانه
3. پیوند داتیو (کووالانسی کوئوردینانس)
1. پیوند کووالانسی یگانه
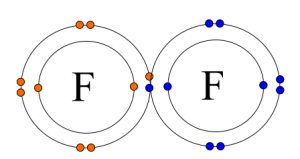
زمانیکه هریک از اتم های درگیر پیوند، برای تشکیل آن، یک الکترون را به اشتراک گذارند، پیوند کووالانسی یگانه تشکیل می گردد؛ به بیانی دیگر، پیوند کووالانسی یگانه متشکل از دو الکترون با اسپین مخالف(3) بوده که اوربیتالی از هر دو اتم درگیر پیوند را اشغال می کند.
نمونه هایی از این پیوند را می توان بین دو اتم هیدروژن، دو اتم فلوئور یا دو اتم کلر مشاهده نمود.
2. پیوند کووالانسی چندگانه
ممکن است هنگام تشکیل پیوند، اتم ها برای رسیدن به پایداری، بیش از یک الکترون را به اشتراک گذارند؛ که در این حالت به پیوند کووالانسی ایجاد شده را، پیوند کووالانسی چندگانه گویند و این نوع پیوند را، با توجه به تعداد جفت الکترون به اشتراک گذاشته شده بصورت زیر نامگذاری می کنند:
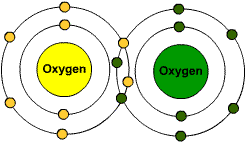
1. پیوند کووالانسی دوگانه، حاصل از اشتراک دوجفت الکترون بین دو اتم می باشد؛ مانند پیوند بین دو اتم اکسیژن.
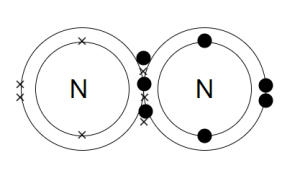
2. پیوند کووالانسی سه گانه، حاصل از اشتراک سه جفت الکترون بین دو اتم می باشد؛ مانند پیوند بین دو اتم نیتروژن.
و به همین ترتیب، نامگذاری برای جفت الکترون های بیشتر ادامه می یابد.
پیوند داتیو (کووالانسی کوئوردینانس)
زمانی که یک اتم تنها اوربیتال خالی و اتم دیگر زوج الکترون غیرپیوندی(4) داشته باشد چنین پیوندی ایجاد می گردد؛ درواقع برای تشکیل پیوند، یک اتم اوربیتال خالی و اتم دیگر الکترون به اشتراک می گذارد و به همین دلیل برای نامگذاری آن از واژه ی یونانی داتیو، به معنای بخشنده استفاده شده است.
1. به توانایی نسبی اتم ها در کشیدن الکترون های اتم های دیگر به سمت خود، الکترونگاتیوی گویند.
2. منطقه ای در فضای اطراف هسته اتم، که احتمال یافتن الکترون در آن وجود دارد.
3. چرخش الکترون به دور خود را حرکت اسپینی گویند؛ که جهت این چرخش می تواند ساعتگرد یا پادساعتگرد باشد.
4. جفت الکترونی که در تشکیل پیوندی شرکت نکرده باشند.








