الکترولیز، یک نوع واکنش شیمیایی است
الکترولیز در یک کلام و به طور کاملا خلاصه به معنی شکافتن ترکیبات با استفاده از جریان برق است. این فرآیند در دسته واکنش های شیمیایی قرار گرفته و یک تغییر شیمیایی (نه فیزیکی) به حساب می آید. در طی یک فرآیند الکترولیز، مواد موجود در واکنش به مواد دیگری تبدیل شده و خواص شیمیایی جدیدی ظاهر می شود. بنابراین می توان چنین برداشت کرد که یک فرآیند الکترولیز حتما یک واکنش شیمیایی است.
به عنوان مثال، الکترولیز نمک طعام منجر به ایجاد گاز هیدروژن، گاز کلر و سدیم هیپوکلریت می شود. بنابراین، الکترولیز نمک یک واکنش شیمیایی است؛ چون مواد اولیه با فرآورده های ناشی از انجام واکنش تفاوت های بنیادینی در خواص شیمیایی نشان می دهند. در این واکنش، مواد اولیه فقط آب و نمک است اما فرآورده ها گاز هیدروژن، گاز کلر و سدیم هیپوکلریت می باشد.
الکترولیز در نگاهی بنیادین
اگر بخواهیم به صورت بنیادین به بحث الکترولیز (برقکافت) نگاه کنیم؛ باید چنین گفت که در هر فرآیند الکترولیز، ما با استفاده از جریان برق، بین زوج یون ها فاصله ایجاد می کنیم. این تعریف بسیار دقیق و صحیح است. اما بیایید به شرح و بررسی آن بپردازیم. برای این کار، ابتدا باید نگاهی به انحلال نمک ها داشته باشیم.
همانطور که می دانید؛ هنگامی که یک نمک قابل انحلال در آب را به محیط آبی اضافه می کنیم (نمک را در آب حل می کنیم) شبکه بلورین نمک دچار فروپاشی شده و زوج یون ها (آنیون و کاتیون) در محیط آبی پراکنده می شوند. توجه داشته باشید که یون ها از هم جدا نمی شوند. نیروی جاذبه الکترو استاتیکی (نیروی جاذبه بین یک بار منفی (آنیون) و یک بار مثبت (کاتیون)) باعث می شود تا این ذرات در فاصله بسیار بسیار کمی از هم قرار بگیرند اما به هر جا که حرکت کنند همراه باشند.
برای درک بهتر فرآیند انحلال نمک ها باید با یک مثال ساده پیش برویم. می توانید این طور تصور کنید؛ ما یک سالن سینما داریم که زوج های جوان برای دیدن فیلم در آن نشسته اند. در ابتدا، زوج ها به صورت یک در میان صندلی ها را پر کرده اند (یکی آقا و یکی خانم). پس از اتمام پخش فیلم، هر یک از آن ها از سالن خارج می شود و به مسیر خاص خود می رود؛ در حالی که هنوز هم زوج، زوج (یک آقا به همراه یک خانم) است.
در این مثال، شبکه بلور مثل سالن سینما است. یک آنیون در کنار یک کاتیون و با یک نظم مشخص و تکرار شونده قرار گرفته است. این نظم در سه محور مختصات تکرار شده و یکسان است. پس از انحلال نمک در آب، این ساختار به هم می ریزد؛ در حالی که زوج یون ها همچنان در کنار هم هستند؛ اما دیگر در قالب یک شبکه منظم و مشخص قرار ندارند. درست مثل زوج هایی که در سالن به صورت نظم یافته و مشخص در کنار هم نشسته بودند؛ اما پس از اتمام فیلم سالن را ترک می کنند اما همچنان به صورت زوج با هم حرکت می کنند.
توجه داشته باشید که هر آنیون به همراه یک کاتیون حرکت می کند؛ اما دیگر خبری از شبکه نیست. حال برای جدا کردن این زوج یون ها، ما نیاز به یک نیروی قوی داریم تا بر جاذبه الکترواستاتیک بین یون های با بار مخالف غلبه کند و یا به چیزی نیاز داریم تا حالتی ایجاد کند که دیگر زوج یون ها در کنار هم باقی نمانند. یعنی حالتی ایجاد شود که زوج یون ها دیگر یون نباشند تا بتوانند یکدیگر را ترک کنند.
در فرآیند الکترولیز ما این نیرو را با استفاده از قطب های مثبت و منفی الکترولیز اعمال می کنیم. قطب مثبت یون های منفی و قطب منفی یون های مثبت را به سوی خود می کشد. این نیرو به حدی زیاد است که بر جاذبه الکترواستاتیکی بین زوج یون ها غلبه کرده و در نهایت آن ها را از هم جدا می کند. در حالتی دیگر، هر ماده روی یک الکترود خاص اکسید و یا احیا می شود و به علت نبود نیروی الکترواستاتیکی، هر زوج یون از زوج یون خود جدا می شود.
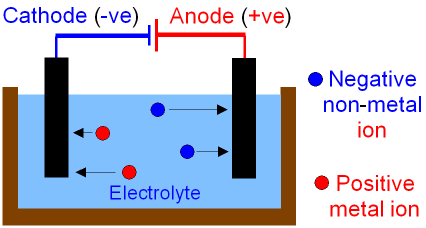
الکترولیز فرآیندی است که در نهایت منجر به جدایش بین ترکیبات می شود. به خاطر داشته باشید که هر جا پسوند لیز آورده شود، به معنی یک شکافت است. مثلا هیدرولیز یعنی شکافت با استفاده از آب، الکترولیز یعنی شکافت با استفاده از جریان الکتریسیته و… .
هر سل الکترولیز در واقع یک سل الکترولیتی است. به این معنی که در این سل، با استفاده از جریان الکتریسیته، یک واکنش شیمیایی انجام می شود. اما هر سل از چه قسمت هایی تشکیل شده است؟
یک سل الکترولیز چه چیز هایی دارد؟
هر سل الکترولیز از یک منبع که حاوی مواد است که به آن الکترولیت گفته می شود؛ دو الکترود آند و کاتد و نیز یک منبع تولید کننده جریان الکتریسیته ساخته شده است. بسته به کاری که انجام می شود؛ این الکترود ها می توانند از جنس های مختلفی ساخته شوند. ما سل هایی با الکترود های گرافیتی، پلاتینی، سربی، استیل و… داریم. هر کدام از این الکترود ها خاصیت خاص خودش را دارد که متناسب با مواد موجود و هدف الکترولیز انتخاب می شود.
جنس الکترود ها بسیار اهمیت دارد. گاهی خود الکترود می تواند فرآیند الکترولیز را کاتالیز کرده و سرعت انجام واکنش را خیلی بالاتر ببرد و برعکس. پارامتر مهم بعدی اختلاف پتانسیلی است که بین این دو الکترود اعمال می شود. هر ماده ای برای انجام واکنش ویژه الکترولیز اش باید در یک پتانسیل خاص قرار بگیرد. پارامتر مهم بعدی جریان است.
شدت جریان نیز در یک فرآیند الکترولیز بسیار مهم است. پارامتر مهم بعدی فاصله بین الکترود ها است. برای انجام یک فرآیند الکترولیز، فاصله بین آند و کاتد نیز یک نقش تعیین کننده و بسیار مهم دارد. هر چه فاصله بین الکترود ها بیشتر باشد، به اختلاف پتانسیل بالاتری برای انجام فرآیند نیاز داریم.
الکترولیز چه کاربرد هایی دارد؟
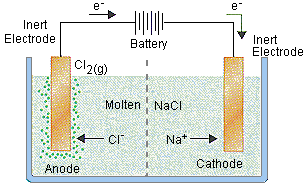
الکترولیز در صنعایع معدنی بسیار پرکاربرد است. مثلا با استفاده از الکترولیز آب نمک، می توان گاز کلر و سدیم هیپوکلریت (وایتکس) تهیه کرد. این یکی از فرآیند هایی است که به صورت گسترده در صنعت انجام می شود. به طور کلی از الکترولیز برای جدایش یون های موجود و ایجاد ترکیبات جدید در قالب نمک و یا فلز خالص استفاده می شود.
به عنوان مثال، می توانیم با استفاده از الکترولیز نمک مذاب، عنصر سدیم را به صورت فلزی استخراج کنیم. همچنین یکی از فرآیند هایی که به شدت در صنعت استحصال فلزات استفاده می شود؛ الکترولیز نمک سولفات مس برای تولید مس فلزی با خلوص 99.999 است.