[vc_row][vc_column][vc_column_text]
اوربیتال اتمی
تابع موج یک الکترون در یک اتم هیدروژن مانند را اوربیتال اتمی می نامند. اوربیتال های اتمی هیدروژن مانند در درک بخش عمده ای از مفاهیم شیمی معدنی نقش کلیدی ایفا می کنند، پس به دلیل اهمیتشان درمورد آنها صحبت می کنیم:
ترازهای انرژی هیدروژنی
هر یک از توابع موجی که از حل معادله ی شرودینگر برای اتم های هیدروژن مانند به دست می آید، به شکلی متفاوت، توسط سه عدد صحیح به نام اعداد کوانتومی مشخص می شود. این اعداد کوانتومی را با (ml, l, n) نمایش می دهند: n به عدد کوانتومی اصلی موسوم است، lعدد کوانتومی گشتاور زاویه ای اوربیتال (که نام قبلی آن عدد کوانتومی فرعی است)، و ml عدد کوانتومی مغناطیسی نامیده می شوند.
اعداد کوانتومی
هر یک از این اعداد کوانتومی مشخص کننده ی یک خاصیت فیزیکی الکترون است: nمشخص کننده اندازه وانرژی است که منظوراز اندازه اوربیتال، فاصله الکترونها از هسته اتم است،تمامی الکترونهایی که n آنها با هم برابر است، در فاصلهای یکسان از هسته اتم قرار میگیرندو هرچه اندازه n بیشتر باشد الکترون ها در فاصله ای دورتراز هسته اتم هستندوانرژی اوربیتال بالاتر,گسترده تر از اوربیتال های دارای انرژی پایین هستند که فشرده تر اند.
l معرف گشتاور زاویه ای اوربیتال و یا به زبانی ساده تر نشان دهنده ی شکل اوربیتال است(که در ادامه شکل های آن را مشاهده می کنیم)و با افزایش آن تعداد لب های اوربیتال نیز افزایش می یابد. یک لایه با عدد کوانتومی n می تواند از n-1 اوربیتال مختلف تشکیل شده باشد.
ml معرف جهت گیری گشتاور زاویه ای است. مقدارml جهت گیری اوربیتال را نیز مشخص می کند. عدد مغناطیسی یک اوربیتال, بین l- تا l+ قرار دارد. برای نمونه اعداد کوانتومی مغناطیسی برای اوربیتال p که L مربوط با آن ۱ است، برابر با 1+,1,0- در نظر گرفته میشوند.
با کمک سه عدد کوانتومی اندازه, شکل و جهت گیری اوربیتال های اتمی تعیین می شود.اما الکترون به دور خودش نیز می چرخد که این چرخش را با عدد کوانتومی اسپینی یا ms نشان میدهند. پس یک الکترون میتواند تنها ساعتگرد (s=-1/2) و یا پادساعتگرد (s=+1/2) چرخش کند.
بر اساس طرد پاولی در یک اتم هیچ دو الکترونی را نمیتوان یافت که تمام چهار عدد کوانتومی آن یکسان باشد.
لایه های فرعی
در یک اتم هیدروژن مانند, همه ی اوربیتال هایی که مقدار یکسانی دارند را همتراز می نامند. با این ترتیب عدد کوانتومی اصلی, یک سری ازلایه ها و یا مجموعه هایی از اوربیتال ها با n یکسان دراتم را مشخص می کند که انرژی و شعاع تقریبی آنها یکسان است. اوربیتال های متعلق به هر لایه به لایه های فرعی دسته بندی و با عدد کوانتومی l می تواند از0 تا n-1 را اختیار کند که در مجموع n مقدار خواهد شد. به عنوان نمونه لایه ی n=1 تنها از یک لایه ی فرعی با l=0 تشکیل شده است. چنین مرسوم است که هرلایه ی فرعی با یک حرف مشخص می شود:
| …. | 4 | 3 | 2 | 1 | 0 | مقدار l |
| …. | g | f | d | p | s | نشان اوربیتال |
| 3 | 3 | 3 | 2 | 2 | 1 | n |
| 2 | 1 | 0 | 1 | 0 | 0 | l |
| 3d | 3p | 3s | 2p | 2s | 1s | اوربیتال |
برای بیشتر پدیده ها درشیمی بیشتر از لایه های فرعی s, p, d وf استفاده می شود.
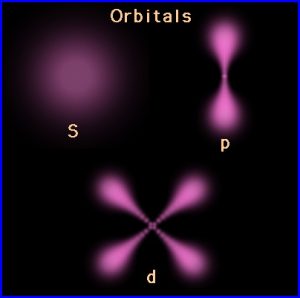
اوربیتال s
تابع موج زاویه ای اوربیتال s مستقل از زوایای ϕ(فی) وΦ(تتا) است. به همین دلیل این اوربیتال دارای تقارن کروی بوده و در تمام جهات قادر به همپوشانی است و نسبت به تمامی صفحه های مختصات کروی است. این کره را سطح مرزی اوربیتال می نامند. و ناحیه ای از فضا را مشخص می کند که احتمال بالایی (معمولا 75%) برای یافتن الکترون درآن ناحیه وجود دارد.
اوربیتال های p
تابع موج زاویه ای اوربیتال های p وابسته به زوایای ϕ(فی) وΦ(تتا) بوده و نمودار آن دمبلی شکل می باشد که علامت لب های آن مخالف هم است. البته اوربیتال pz که در راستای محور z گسترش یافته, مستقل از زاویه ϕ(فی) بوده و فقط به زاویه Φ(تتا) وابسته است. این اوربیتال ها همه روی محوری اند و نسبت به صفحه هایی که در بر گیرنده محور اوربیتال p باشند متقارن خواهند بود. برای مثال؛ اوربیتال px نسبت به صفحه های xy و xz که محور x را دربر می گیرند متقارن است.هر یک از اوربیتال های p صفحه گره ای دارد که از هسته می گذرد و لب های مثبت و منفی را ازهم جدا می کند.هر اوربیتال p دارای یک صفحه گره ای است.
اوربیتال های d
تابع موج زاویه ای اوربیتال های p به زاویه های ϕ(فی) وΦ(تتا) وابسته است(بجز اوربیتالdz^2 که فقط به Φ وابسته است). نمودار تابع موج زاویه ای آنها دمبلی شکل می باشد با این تفاوت که هر اوربیتال d از دو دمبل یا چهار لب تشکیل شده که علامت لب های روبروی هم یکسان است. هر اوربیتال d دارای دو صفحه گره ای است که در هسته یکدیگر را قطع می کنند و هر اوربیتال f دارای سه صفحه گره ای است به طور کلی یک اوربیتال با عدد کوانتومی l دارای l سطح گره است.
اوربیتال s در هسته max است ولی اوربیتال p,d,f در هسته صفر می باشند.
[/vc_column_text][/vc_column][/vc_row][vc_row][vc_column width=”1/3″][/vc_column][vc_column width=”1/3″][tlg_button title=”از ما حمایت کنید .” btn_link=”url:https%3A%2F%2Fidpay.ir%2Fshimidoon|||” btn_size=”btn-block” layout=”btn btn-filled btn-light btn-rounded” hover=”hvr-pop” icon=”ti-money” button_icon_hover=”yes” css_animation=”fadeIn” customize_button=”yes” btn_custom_layout=”btn btn-rounded” btn_color=”#ffffff” btn_bg_gradient=”#870501″ btn_bg_gradient_hover=”#eded00″ btn_bg_hover=”#d80700″ btn_border_hover=”#43c100″ btn_bg=”#1e0000″][/vc_column][vc_column width=”1/3″][/vc_column][/vc_row]