در هیچ گروهی ازگروههای جدول قرار نمیگیره
از بعضی جهات به گروه فلزهای قلیایی و از جهاتی هم به هالوژنها شباهت داره
اما تفاوت هایی هم که با این گروه داره باعث شده که هیدروژن در جدول تناوبی جایگاه منحصر به فردی رو داشته باشه
- هیدروژن فراوانترین عنصر در کره ی زمین است
- هیدروژن یکی از عنصرها سازنده ی سوخت های فسیلی است
- هیدوژن سبکترین عنصر و مولکولی گازی بی رنگ بی بو و بدون طعم است
- هیدروژن گازی آتشگیر است و بر اثر جرقه یا دمای بالا با اکسیژن ترکیب با آب تشکیل می دهد
ایزوتوپ های هیدروژن
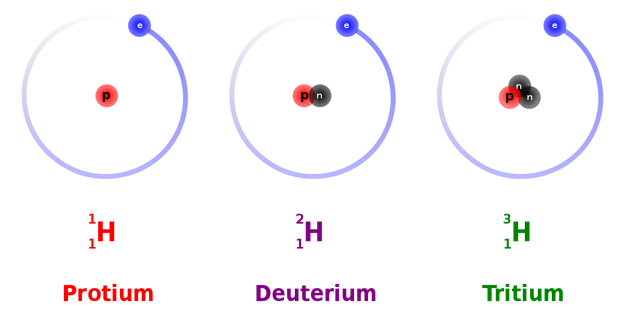
1)هیدروژن معمولی پروتیومH
2)هیدروژن سنگین دوتریمD
3)هیدوژن پرتوزا T
طرز تهیه ی هیدروژن

طرز تهیه آن در صنعت:
در صنعت به طور عمده از واکنش آب و هیدروکربنها به دست می آید.
دانشمندان کشف کردند که بعضی از جلبکها و باکتری ها هیدروژن تولید می کنند. در حال حاضر تولید هیدرژن بسیار گران است.
هیدروژن به عنوان محصول فرعی در هنگام تهیه ی بنزین نیز بدست می آید.
طرز تهیه آن در آزمایشگاه:
برای تهیه ی هیدروژن در آزمایشگاه میتوان از اثر فلز روی (Zn) بر اسیدهای معدنی رقیق استفاده کرد.
Zn+2HCl –> H2+ZnCl2
همچنین تعدادی از فلز ها نظیر قلع آلومینیوم روی و سیلسیم (یک نیمه رساناست)از محلول آبی یک باز قوی مثل سدیم هیدروکسید هیدروژن آزاد می کنند.
کاربردهای هیدوژن

- هیدروژن به عنوان سوخت از جمله سوخت موشک و برای کاهیدن کاتیون های حاوی اکسید برخی از فلزها به کار می رود.
- ناسا اولین کاربر هیدروژن به عنوان ناقل انرژی است که هیدروژن را برای سالها در برنامه ی فضایی مورد استفاده قرار داد.سوخت هیدروژن موشک فضایی را به مدار می رساند.
- سلولهای سوختی هیدروژن یا باتریهای هیدروژنی برق تولید می کند آنها بسیار کارآمد هستند اما ساخت آنها گران است سلول های سوختی کوچک می توانند برق مناطق دور دست را تامین کند.
- هیدروژن ممکن است بزودی به گاز طبیعی اضافه شودتا از آلودگی دستگاههای موجود بکاهد موتوری که هیدروژن خالص می سوزاند تقریبا هیچ آلودگی ندارد.
کاربرد های صنعتی هیدروژن
کاربرد های مهم صنعتی هیدروژن عبارتند از:
1)تولید آمونیاک ازN2 و H2
با استفاده از فرآیند هابر
2)تولید هیدروژن کلرید از Cl2 وH2
3)سنتز متیل الکل از COو H2
4)پالایش نفت
5)هیدروژن دار کردن روغن های خوراکی مثل ذرت و سویا و… برای تولید انواع فراورده های غذایی


هیدروژن و سری الکتروشیمیایی

سری الکتروشیمیایی فهرستی از عناصر است که معمولا عناصر فلزها را شامل می شود
جدول سری الکتروشیمیایی برحسب کاهش تمایل این عناصر به از دست دادن الکترون در محلول آبی تنظیم شده است.
در این سری،یک فلز آزاد می تواند از محلول آبی یون فلزی که در زیر آن قرار گرفته است،فلز مربوطه را ازاد کند.
مثال
Mg(s)+Cu2+(aq) –> Cu(s) + Mg2+(aq)
در این واکنش ،فلز منیزیم اکسید و یون مس (II) کاهیده شده است.
هیدروژن در این فهرست به عنوان یک نقطه ی مرجع است .جدول به دو سری بالای هیدروژن باE0 منفی و پایین هیدروژن با E0 مثبت تقسیم بندی می شود که هر چه عنصر بالا تر باشد میل بیشتری به الکترون دهی دارد و هر چه پایین تر باشد میل بیشتر به الکترون گیری دارد .
به عبارت بهتر در یک سلول الکتروشیمیایی شامل یک الکترود از بالای هیدروژن و دیگری از پایین هیدروژن ، آنکه بالاتر است نقش آند و آنکه پایین تر است نقش کاتد را دارد.
در این جدول عنصر پتاسیم(K)، منفی ترین E0 را دارد و این به این معنی است که از همه عناصر بهتر الکترون می دهد پس کاهنده ترین است.
و عنصر F مثبت ترین E0 را دارد و این یعنی از همه بهتر الکترون می گیرد پس اکسنده است.