بسیار پیش می آید که محلولی غلیظ داشته باشیم و بخواهیم آن را تا حد مشخصی رقیق کنیم. در این حالت فرمول های ویژه رقیق سازی به ما کمک می کند تا این کار را با حداکثر دقت انجام دهیم. در این مقاله به بحث و بررسی کامل بحث رقیق سازی و قواعد و فرمول های آن می پردازیم.
رقیق سازی چیست؟
پیش از بررسی کامل قواعد رقیق سازی بیایید درباره مفهوم آن صحبت کنیم. فرض کنید که محلولی با غلظت 40 درصد وزنی از نمک در آب داشته باشید و بخواهید از این محول، محلولی با غلظت 10 درصد وزنی بسازید. در این زمان باید از قواعد خاصی استفاده کنید تا با همین محلول حاضر،محلول دلخواه خودتان را بسازید.
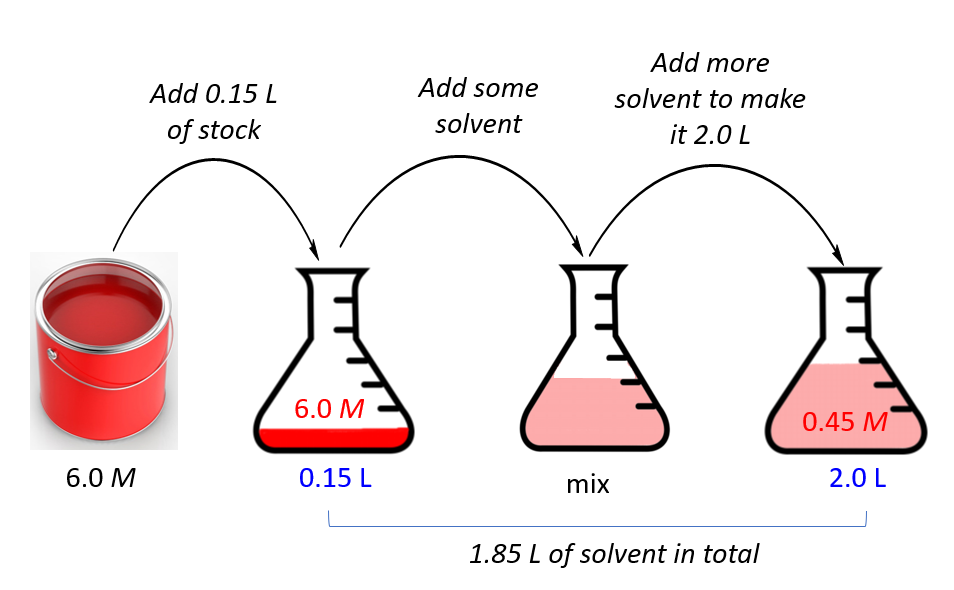
رقیق سازی در یک کلام یعنی کم کردن غلظت گونه های حل شونده در حلال. این حلال می تواند آب، الکل، اتر، انواع روغن و… باشد. ما مقدار حلال را زیاد می کنیم تا محلول نهایی که ساخته می شود؛ نسبت به محلول اولیه، به مقدار کمتری حل شونده را به ازای یک واحد محلول داشته باشد.
قبول دارم که پاراگراف بالا کمی سخت شد؛ بنابراین آن را ساده می کنیم. فرض کنید که 100 میلی لیتر محلول 40 درصد نمک در آب داشته باشید. در این صورت به ازای هر 1 میلی لیتر از این محلول، باید 0.4 گرم نمک وجود داشته باشد. یعنی اگر یک میلی لیتر از این نمک را برداریم و آب آن را بخار کنیم؛ در نهایت آن چه که باقی می ماند 0.4 گرم نمک خواهد بود.
حال اگر از این محلول، محلول جدیدی بسازیم که به ازای هر 1 میلی لیتر از آن 0.1 گرم نمک وجود داشته باشد؛ می گوییم که ما رقیق سازی انجام داده ایم. در فرآیند رقیق کردن، ما به ازای یک حجم مشخص از محلول، مقدار حل شونده را کاهش می دهیم و این کار را به آسانی از طریق افزایش مقدار حلال انجام می شود.
فرمول رقیق سازی
فرآنید رقیق کردن را می توان با داشتن انواع درصد، مولاریته، مولالیته، نرمالیته و… انجام داد. همه این ها از یک فرمول عمومی تبعیت می کند. فرمول عمومی برای رقیق کردن محلول ها به صورت زیر است.
در این معادله، X و Y هر دو نشان دهنده غلظت حل شونده در محلول هستند و باید از یک جنس باشند. مثلا اگر X بر حسب مولاریته است؛ باید Y نیز بر حسب مولاریته باشد و… . V ها نیز حجم محلول، قبل و بعد از رقیق سازی هستند. 1 برای قبل از رقیق کردن و 2 برای بعد از رقیق کردن است.
بیایید با یک مثال ادامه دهیم:
100 میلی لیتر محلول 40 درصد وزنی – وزنی از نمک در آب داریم. چقدر آب اضافه کنیم تا محلولی با 10 درصد وزنی – وزنی نمک در آب داشته باشیم؟
بنابراین محاسبه، باید حجم محلول نهایی را به 400 برسانیم تا غلظت 40 درصد به 10 درصد کاهش یابد. با توجه به این که محلول اولیه ما 100 میلی لیتر بوده است. بنابراین باید 300 میلی لیتر آب به آن اضافه کنیم تا در نهایت، غلظت آن 10 درصد شود.
همنی کار را می توان با داشتن مولاریته، نرمالیته و… نیز انجام داد. تنها کافی است که به جای X و Y، مقدار هر یک از این ها را قرار دهیم. بیایید مثالی دیگر را حل کنیم:
270 لیتر محلول 0.32 مولار از سولفوریک اسید داریم که می خواهیم آن را تا 0.25 مولار رقیق کنیم؛ چقدر آب لازم است تا این محلول به غلظت دلخواه برسد؟
بنابر محاسبه بالا، باید 75.6 لیتر آب به محلول اولیه مان اضافه کنیم تا در نهایت غلظت آن به 0.25 مولار برسد.
به همین ترتیب می توان مثال های بسیار زیادی ساخت و آن ها را به آسانی حل کرد. تنها کافی است بدانید که ما یک نسبت ساده ایجاد می کنیم و سپس آن را حل می کنیم تا به حجم محول نهایی برسیم. پس از آن حجم محلول نهایی را از حجم اولیه محلول کم می کنیم تا به مقدار حلالی که باید اضافه کنیم برسیم.