اوربیتال های اتمی کربن، هیبریدشدن
<<بسم الله الرحمن الرحیم>>
((اوربیتال اتمی کربن))
تمام ترکیبات آلی اسکلت کربنی دارند. اتم کربن دارای 1 الکترون فرد در هریک از2 اوربیتال است.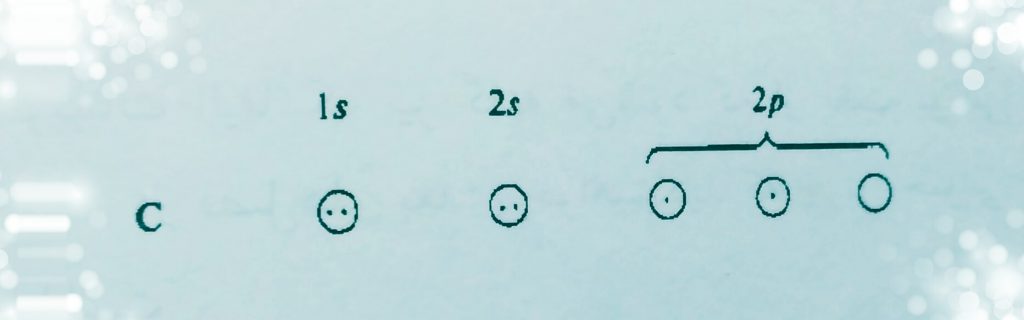
براساس این آرایش انتظار می رود از همپوشانی هیدروژن با اوربیتال 2p کربن ترکیبی با فرمول CH٢تولید شود.اما در واقع مولکول CH٢ ناپایدار است و مدت زمان زیادی ۴ اوربیتال هیبریدی در امتداد شناخت مشخصات آن نمی گذرد در حقیقت دو ترکیب و فرمولCH٢وجود دارد که هر دوی آنها فوقالعاده واکنش پذیرند در این مولکول زاویه پیوند 90 درجه نیست و مولکول کمبود الکترون دارد یعنی در پوسته خارجی کربن به جای 8 الکترون ،که معمولاً مربوط به نظم الکترونی پایدار است فقط ۶ الکترون وجود دارد از سوی دیگر می دانیم که فرمول مولکولی ساده ترین هیدروکربن پایدار CH۴است که در آن ۴ پیوند C—Hبنابراین به مفهوم جدیدی نیاز داریم که بتواند ساختمان مولکولی ترکیبات آلی از قبیل متان با پیوندهای معادل و زوایای مساوی در حدود 109 درجه را توجیه نماید.
«هیبرید شدن»
ساده ترین هیدروکربن متان است که دارای 4 پیوند معادل و هم انرژی با زوایای برابر می باشد ساختار هندسی متان 4 وجهی منظم است که اتم های هیدروژن در چهارگوشه و اتم کربن در مرکز آن قرار دارد و زوایای بین پیوندها 109/5 درجه است.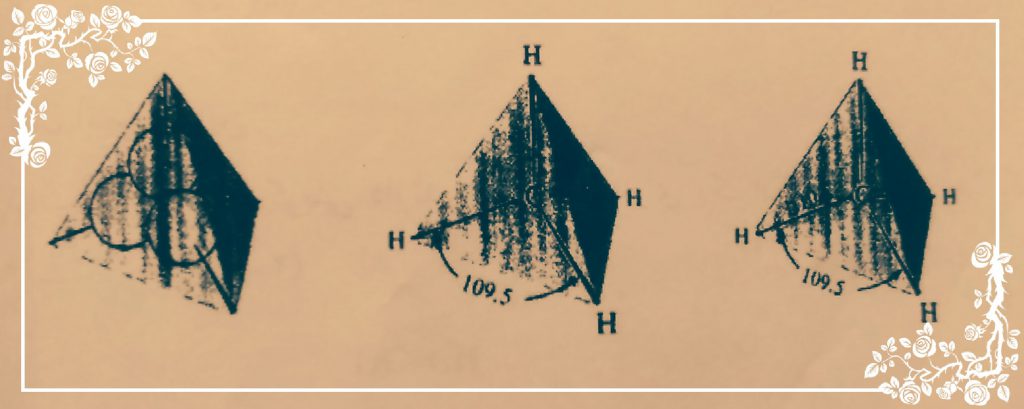
می دانیم که کربن دارای یک الکترون فرد در هر یک از دو اوربیتال p می باشد.
برای اینکه اتم کربن بتواند با چهار اتم در اطراف خود پیوند ایجاد نماید باید چهار الکترون فرد داشته باشد بدین منظور اتم کربن از لحاظ الکترونیک باید برانگیخته باشد لذا یکی از الکترون های 2s به اوربیتال خالی 2pانتقال مییابد انرژی اوربیتال ها در حالت برانگیخته با هم یکسان نیستند «زیرا انرژی اوربیتال های 2sو2pباهم مساوی نیستند.»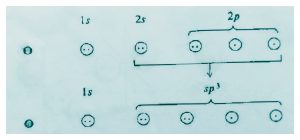
در اثر پدیده هیبرید شدن یک اوربیتال 2s وسه اوربیتال 2p با هم ترکیب میشوند و چهار اوربیتال معادل و هم انرژی sp3ایجاد میکنند. به بیان ساده از ترکیب توابع موجی اوربیتالهای پی و از توابع موجی جدیدsp3 تشکیل می شود طبق مکانیک کوانتومی تعداد اوربیتال های جدیدی که تشکیل میشوند باید با تعداد اوربیتال های سازنده آنها برابر باشند بدین ترتیب کربن دارای چهار اوربیتال هیبریدی 2sp3است که 2 مشخصکننده عدد کوانتومی اصلی و sp3نشان دهنده مجموعه از یک چهارم S و سه چهارم pمی باشد.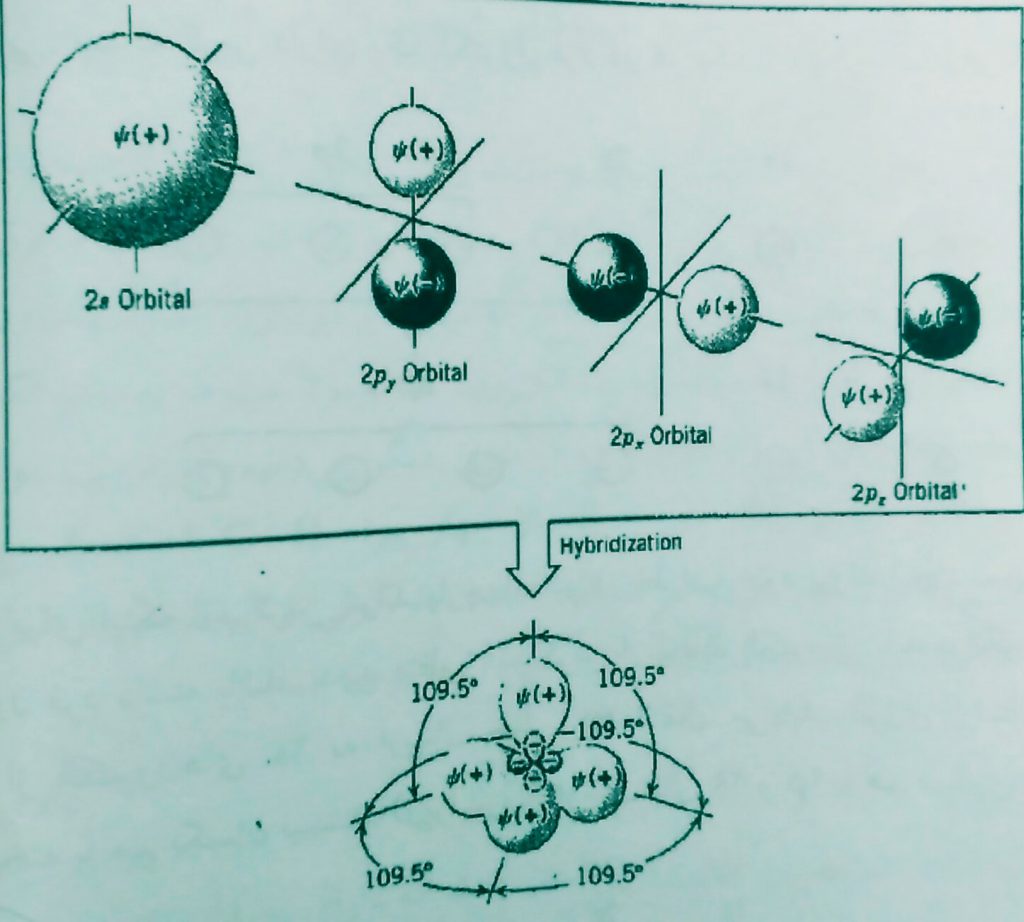
محورهای اصلی این ۴ اوربیتال هیبریدی در امتداد خطوط ای است که اگر در فاصله ثابتی از هسته به هم متصل شوند یک چهار وجهی ایجاد می کند و زاویه بین دو خط متقاطع ۱۰۹ درجه است.
از همپوشانی هر یک از اوربیتال هایsp3 کربن با اوربیتال s هیدروژن با آرایش هندسی چهار وجهی منظم به وجود میآید که در آن کربن در مرکز چهار وجهی و چهار هیدروژن در چهار گوشه آن قرار دارد.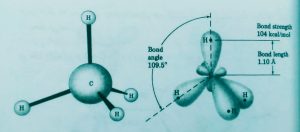
پیوند کربن هیدروژن پیوند سیگما است. اوربیتال های هیبریدیsp٣ در مقایسه با اوربیتال هیبرید نشدهsیاp یک لپ بزرگ (لپ جلویی) قرار دارد که برای همپوشانی و برقراری پیوندی محکم بسیار مناسب است.
اکنون به اتانC2H6 عضو دوم خانواده آلکان ها توجه کنید در این مولکول دو اتم کربن به یکدیگر پیوند دارند در این مورد پس از آنکه یک اتم هیدروژن با سه اوربیتال هیبریدیsp٣ کربن پیوند یافت چهارمین اوربیتال هیبریدی این کربن با اوربیتال هیبریدی کربن دیگر که سه اوربیتالsp٣ آن با سه اتم هیدروژن پیوند یافته است پیوند سیگمای C__ C را ایجاد می کند.
نکته:( در اتان زاویه پیوندC_C_H و زاویه پیوندCH2 تقریباً ۱۰۹ درجه است.)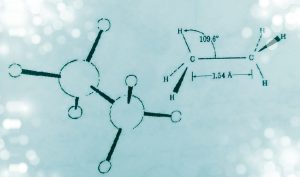
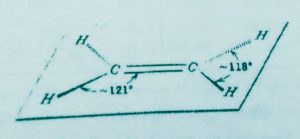
دسته دیگر هیدروکربن ها اولفین ها یا آلکن ها به فرمول کلیCnH٢n هستند ساده ترین عضو این گروه اتیلن C2H4 است زاویه پیوند در این مولکول ۱۲۰ درجه و مولکول مسطح است هردو کربن در اتیلن به صورتsp٢ هیبرید شده اند بدین ترتیب که یک اوربیتال 2sو دو اوربیتال 2p هیبرید شده و سه اوربیتالsp٢ ایجاد می کنند اوربیتال های sp٢ از نظر شکل مشابه اوربیتال هایsp٣ هستند .اما آرایش فضایی آنها تفاوت دارد از جمله آن که زاویه آنها ۱۲۰ درجه است و با این زاویه محورهای اصلی سه اوربیتال sp٢ در یک صفحه قرار دارند و به طرف گوشه های متساوی الاضلاع کشیده شدهاند بدین ترتیب حداکثر فاصله بین زوج الکترون های پیوندی ایجاد میشود.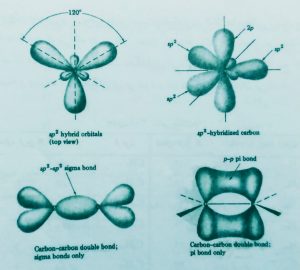
هر یک از اوربیتال هایsp٢با اوربیتال 1s اتم هیدروژن همپوشانی می کند ویک اوربیتال sp٢دیگربا اوربیتالsp٢ باقیمانده کربن دیگر همپوشانی می نماید و پیوند سیگمای کربن _کربن را ایجاد میکند یک اوربیتال p باقی مانده از هر کربن نیز با یکدیگر همپوشانی می کنند در نتیجه پیوند(پی یاpi) ایجاد می شود.