یکی از موضوعات بسیار مهم در شیمی تعادل است. تعادل شیمیایی با تعادل ترمودینامیکی روابط و البته تفاوت هایی دارد. به این معنی که ما می توانیم با استفاده از مفاهیم موجود در تعادل ترمودینامیکی، به وجود تعادل شیمیایی پی ببریم. همچنین با استفاده از تعادل شیمیایی، به تعادل ترمودینامیکی و فرمول های آن نیز برسیم.
این یک بحث طولانی است که در مقاله های دیگر به آن خواهیم پرداخت. اما در این مقاله به بررسی کامل مفهوم تعادل در شیمی و تعادل شیمیایی در واکنش ها خواهیم پرداخت؛ بنابراین بیایید با تعریف تعادل شروع کنیم.
تعادل شیمیایی چیست؟
برای درک و فهم تعادل شیمیایی، ابتدا باید نگاهی به مفهوم تعادل در معنای عام آن بیاندازیم. بندبازی را فرض کنید که روی یک طناب بین دو ستون راه می رود. این بند باز باید بتواند بین خم شدن به چپ و راست و همچنین خم شدن به جلو و عقب یک موازنه ایجاد کند تا بتواند روی بند باقی بماند. در صورتی که نتواند این موازنه را به وجود آورد، سقوط خواهد کرد.

در واکنش های شیمیایی نیز مشابه با چنین پدیدهای می تواند به وجود آید. بسیاری از واکنش ها هم در جهت رفت و هم در جهت برگشت انجام می شوند. به این معنی که هم واکنش دهنده ها به فراورده تبدیل می شوند و هم فراورده ها می توانند به واکنش دهنده تبدیل شوند. بنابراین برای نشان دادن تعادل در یک واکنش شیمیایی، از دو فلش جلو و عقب که بر روی هم قرار گرفته اند استفاده می کنیم.
این یعنی هم واکنش در جهت رفت انجام می شود و هم در جهت برگشت. در این نوع واکنش ها، یک ضریب تحت عنوان ثابت تعادل تعریف می شود که بعداً در مقاله ای جداگانه به آن خواهیم پرداخت. ثابت تعادل نشان می دهد که واکنش های رفت و برگشت با چه نرخی در حال انجام شدن هستند.
برخی تعادل های شیمیایی بسیار قوی و پایدار و برخی دیگر شکننده هستند. البته قواعد و قوانین ویژهای نیز برای هر واکنش تعادلی وجود دارد. به عنوان مثال، اصل لوشاتلیه یکی از مهمترین آن هاست. اصل لوشاتلیه بر روی عوامل بر هم زننده تعادل تمرکز دارد که در مقاله ای ویژه به آن می پردازیم.
تعادل شیمیایی به این معنی است که مواد موجود در واکنش، هم می توانند در قالب مولکول و یا مواد واکنش دهنده هم میتوانند در قالب مولکول و یا مواد فراورده وجود داشته باشند. به عنوان مثال، واکنش بین نیتروژن و هیدروژن برای تولید آمونیاک یک واکنش تعادلی است.
در این واکنش برای یک اتم هیدروژن فرقی ندارد که در قالب یک مولکول هیدروژن باشد و یا در قالب یک مولکول آمونیاک قرار گرفته باشد. در این صورت، یک تعادل بین آمونیاک و هیدروژن برقرار می شود و اتم هیدروژن گاهی در مولکول آمونیاک و گاهی در مولکول هیدروژن قرار می گیرد و هیچ ارجحیتی بین آن ها قائل نمی شود.
ویژگی های یک واکنش تعادلی
در هر واکنش تعادلی دو شرط وجود دارد. یعنی ما با دیدن این دو شرط در هر واکنشی، می توانیم بگوییم که آن واکنش یک واکنش تعادلی است. شرط اول برابر بودن سرعت های رفت و برگشت و شرط دوم ثابت ماندن غلظت ها است.
شرط برابری سرعت ها
در یک واکنش معمولی که یک واکنش در تعادل نباشد؛ واکنش در یک جهت پیشروی کرده و تا تمام شدن مواد واکنش دهنده پیش می رود. این یعنی کلیه مواد واکنش دهنده به فرآورده تبدیل می شود و پس از آن واکنش متوقف می گردد.
اما در یک واکنش تعادلی، پس از آن که واکنش در جهت رفت شروع به انجام شدن می کند و فراورده به وجود می آورد؛ به تدریج واکنش در جهت برگشت نیز آغاز شده و فراورده ها را به مواد اولیه تبدیل می کند. این فرایند رفت و برگشتی تا آنجا ادامه پیدا می کند که سرعت تبدیل واکنش دهنده ها به فراورده و نیز سرعت تبدیل فراورده ها به واکنش دهنده با هم برابر شود. در این شرایط، هیچ یک از واکنش های رفت و یا برگشت بیشتر از دیگری انجام نشده و در نتیجه باعث میشود که واکنش به تعادل برسد.
شرط ثابت شدن غلظت ها
در یک واکنش غیر تعادلی، در گذر زمان، غلظت واکنش دهنده ها کاهش یافته و در نهایت به صفر میرسد. از آن طرف، غلظت فراورده ها از صفر شروع شده و به یک مقدار مشخص ختم می شود. اما در یک واکنش در تعادل چنین چیزی وجود ندارد. اگر نمودار غلظت واکنش دهنده ها و فرآورده ها را برحسب زمان رسم کنیم؛ به شکلی مثل نمودار زیر خواهیم رسید. برای درک بهتر به نمودار زیر توجه کنید.
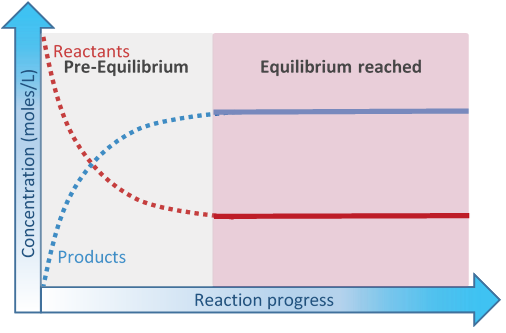
در یک تعادل شیمیایی، غلظت واکنش دهنده ها از یک مقدار مشخص شروع شده و به یک مقدار مشخص دیگر ختم شده؛ همچنین غلظت فراورده ها از صفر شروع شده و سپس به یک مقدار مشخصی ختم می شود. این یعنی غلظت فراورده ها و یا واکنش دهنده ها هیچ وقت به صفر نمی رسد و همیشه مقداری از واکنش دهنده و فراورده به طور همزمان وجود دارد.
نکته ای که در پس این شرط دیده می شود بسیار جالب است. توجه داشته باشید که یک واکنش معمولی، از یک نقطه آغاز شده و در یک نقطه به پایان می رسد. مثلا اگر گاز هیدروژن بخواهد با اکسیژن ترکیب شود و مولکول آب بسازد؛ واکنش با یک مقدار مشخصی از هیدروژن و اکسیژن آغاز شده و با تمام شدن آن ها به پایان می رسد.
اما در یک واکنش تعادلی، ما هیچ گاه به پایان واکنش نمی رسیم و می توان چنین گفت که واکنش های رفت و برگشت دائماً در حال اتفاق افتادن هستند. مشابه با چنین چیزی را ما در یک تعادل فیزیکی بین فرایند تبخیر و میعان نیز دیده ایم.
اگر مقداری آب درون یک بطری بریزید و سپس درب آن را ببندید و در جایی رها کنید؛ پس از مدتی می بینید که جداره داخلی بطری را بخار گرفته است. در این حالت، یک تعادل بین آب آب و بخار آب ایجاد شده است. شما فکر می کنید که هیچ اتفاقی درون بطری نمی افتد؛ در حالی که آب دائماً بخار شده و بخار به آب تبدیل می شود. اما از آن جایی که سرعت این دو فرایند با هم برابر است؛ شما متوجه آن نمی شوید.
در یک تعادل شیمیایی نیز چنین چیزی وجود دارد. واکنش رفت و برگشت در حال انجام شدن است؛ در حالی که شما متوجه آن نمی شوید. البته توجه داشته باشید که انجام یک واکنش تعادلی با یک فرآیند فیزیکی مثل تبخیر و میعان کاملاً متفاوت است. این یک فرآیند شیمیایی است در حالی که تبخیر و میعان دو فرایند کاملاً فیزیکی می باشند.
از کجا مطمئن هستیم که واکنش های رفت و برگشت در حال انجام شدن هستند و متوقف نشده اند؟ اگر یک فرآیند شامل ایجاد و تجزیه بلور را تماشا کنیم؛ متوجه تغییرات دائمی در ساختار بلور می شویم و این یعنی واکنش های رفت و برگشت در حال وقوع هستند.
هر واکنشی که این دو شرط را رعایت کند؛ یک واکنش تعادلی است که برای توصیف آن، دیگر نمی توان از قواعد مربوط به واکنش های معمولی (غیر تعادلی) استفاده کرد.
به این پست چند تا ستاره میدی؟
برای امتیاز دهی روی ستاره ها کلیک کن
امتیاز میانگین 1 / 5. تعداد رای ها 1









