یکی از مهمترین قوانین برای تعیین آنتالپی یک فرآیند چند مرحله ای بدون شک قانون هس می باشد. این قانون مبتنی بر چرخه بورن اپنهایمر بوده و در واقع می توان گفت که مشتقی از آن می باشد. در این مقاله قصد داریم تا به تشریح کامل این قانون پرداخته، کاربرد آن را بیان کرده و در نهایت با ذکر مثال، بحث آن را کامل می کنیم.
قانون هس و تابع حالت بودن آنتالپی
اگر بخواهیم خاستگاه قانون هس را به درستی درک کنیم باد به سراغ بحث تابع حالت و تابع مسیر برویم. همه ما می دانیم کگه یک پارامتر زمانی تابع حالت است که مقدار آن در طی یک فرآیند، وابسته به نقاط ابتدا و انتهایی بوده و ربطی به مسیر طی شده نداشته باشد. آنتالپی نیز یکی از همین توابع است.
در یک فرآیند مشخص، مقدار آنتالپی صرفا به مقدار ابتدا و انتهایی مسیر وابسته بوده و ربطی به مسیر انجام آن فرآیند ندارد. مثلا فرض کنید که می خواهیم کمپلکس معدنی A را به B تبدیل کنیم. دو مسیر با کاتالیزور و بدون کاتالیزور را فرض کنید؛ از آنجایی که آنتالپی یک تابع حالت است؛ بنابراین در هر دو مسیر مقدار یکسانی برای این فرآیند را نشان خواهد داد. در تصویر زیر به این مفهوم دقت کنید.
همانطور که در تصویر نیز مشخص است؛ مقدار آنتالپی دو مسیر آبی و قرمز یکسان بوده و هیچ فرقی بین آن ها وجود ندارد. در حالی که می دانیم در مسیر قرمز از کاتالیست استفاده شده و مسیر آبی رنگ بدون کاتالیزور بوده است. بنابراین این که آنتالپی یک تابع حالت است به ما این امکان را داده تا بتوانیم قانون هس را بپذیریم.
قانون هس چیست؟
قانون هس بیان میکند؛ از آنجایی که آنتالپی یک تابع حالت است؛ بنابراین جمع آنتالپی مراحل مختلف یک واکنش، برابر با آنتالپی کل آن واکنش از ابتدا تا انتها است. به عنوان مثال، اگر یک واکنش سه مرحلهای داشته باشیم؛ قانون هس به ما میگوید که حاصل جمع آنتالپی این سه مرحله، برابر با آنتالپی کل فرایند خواهد بود.
این قانون به ما کمک میکند تا آنتالپی فرایند های چند مرحله ای را به آسانی حساب کنیم. همچنین می توان با استفاده از این قانون به پیش بینی آنتالپی فرایند های دیگر نیز پرداخت و نسبت به شرایط انجام آن ها محاسبات دقیقی را انجام داد. همچنین با داشتن آنتالپی یک فرآیند، با استفاده از فرمول ها و معادلات ساده و پیچیده ترمودینامیکی می توان به محاسبه سایر پارامتر های ترمودینامیکی مثل انرژی آزاد گیبس، آنتروپی و… نیز پرداخت.
تشریح قانون هس و قواعد آن
قانون هس فقط در یک جمله ساده خلاصه نمی شود و قواعدی دارد که در ادامه به تک تک آن ها خواهیم پرداخت:
1_ آنتالپی یک واکنش چند مرحله ای از جمع آنتالپی تک به تک مراحل آن واکنش به دست می آید.
2_ اگر یک واکنش را برعکس کنیم؛ علامت آنتالپی آن عوض می شود.
3_ اگر ضرایب استوکیومتری یک واکنش را در عددی ضرب یا بر عددی تقسیم کنیم؛ آنتالپی آن واکنش نیز در آن عدد ضرب و یا بر آن عدد تقسیم خواهد شد.
چگونه از قانون هس استفاده کنیم؟
برای استفاده از قانون هس، ابتدا باید تمامی مراحل انجام واکنش را زیر هم نوشته و آنتالپی هر کدام را در مقابل آن ها بنویسید. سپس تک تک آن ها را موازنه کرده و سعی کنید تا واکنش کلی را به صورت جمع زنی واکنش های مرحله به مرحله به دست آورید. سپس با تغییراتی که بر روی واکنش مرحله های مختلف انجام داده اید؛ آنتاپی هر مرحله را جدا جدا حساب کنید و در نهایت همه آن ها را با هم جمع بزنید و آنتاپی کل فرآیند را گزارش کنید.
مثال) آنتاپی واکنش زیر را از طریق قانون هس به دست آورید:
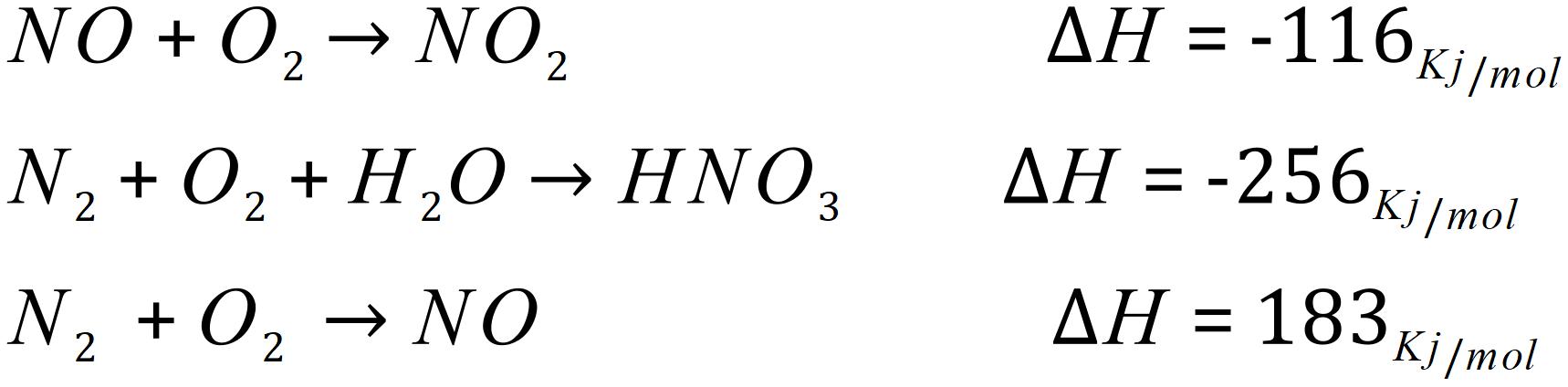
در قدم اول واکنش ها را موازنه می کنیم:
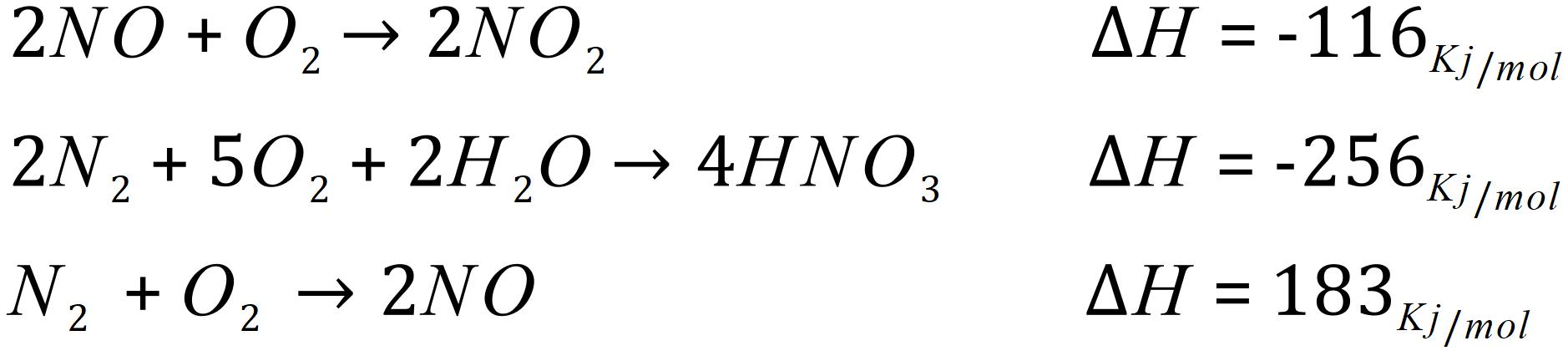
در مرحله بعدی سعی می کنیم تا واکنش نهایی را از جمع واکنش های مرحله به مرحله ای که در اختیار داریم به دست آوریم. واکنش کلی ما به صورت زیر است:
![]()
بنابراین برای رسیدن به آن واکنش اول و سوم را معکوس و واکنش دوم را ثابت نگه می داریم؛ بر اساس قواعدی که در بالا گفتیم؛ اگر واکنشی معکوس شود آنتالپی آن تغییر علامت می دهد بنابراین داریم:
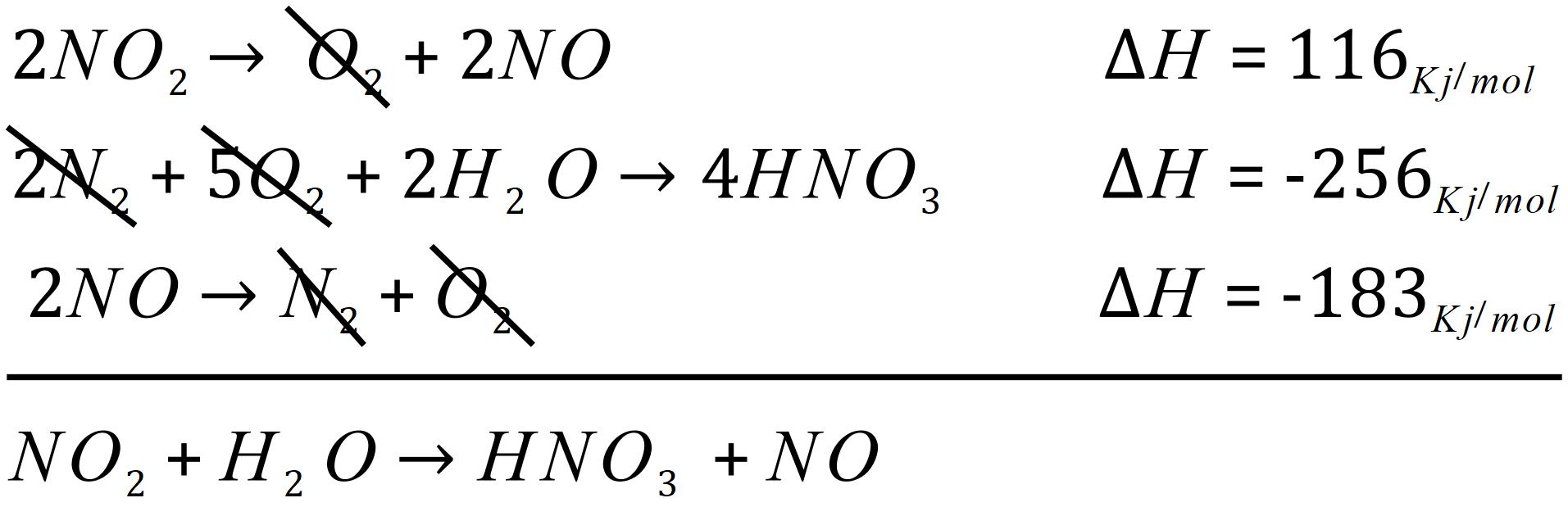
همانطور که در بالا مشاهده می کنید؛ هر عاملی در سمت راست واکنش با همان عامل در سمت چپ واکنش دیگر حذف می شود. در بالا مولکول های اضافی حذف شده و به طور کلی واکنش کلی به دست می آید اما ضرایب استوکیومتری آن مشکل دارد. بنابراین ما باید این ضرایب را به نحوی تغییر دهیم که واکنش نهایی به صورت موازنه شده به دست آید.
بنابراین برای حل مشکل، واکنش اول را در 3/2 و واکنش دوم را در 1/2 ضرب می کنیم. بنابراین آنتاپی هر یک از آن ها نیز در این ضرایب ضرب می شود؛ بنابراین داریم:
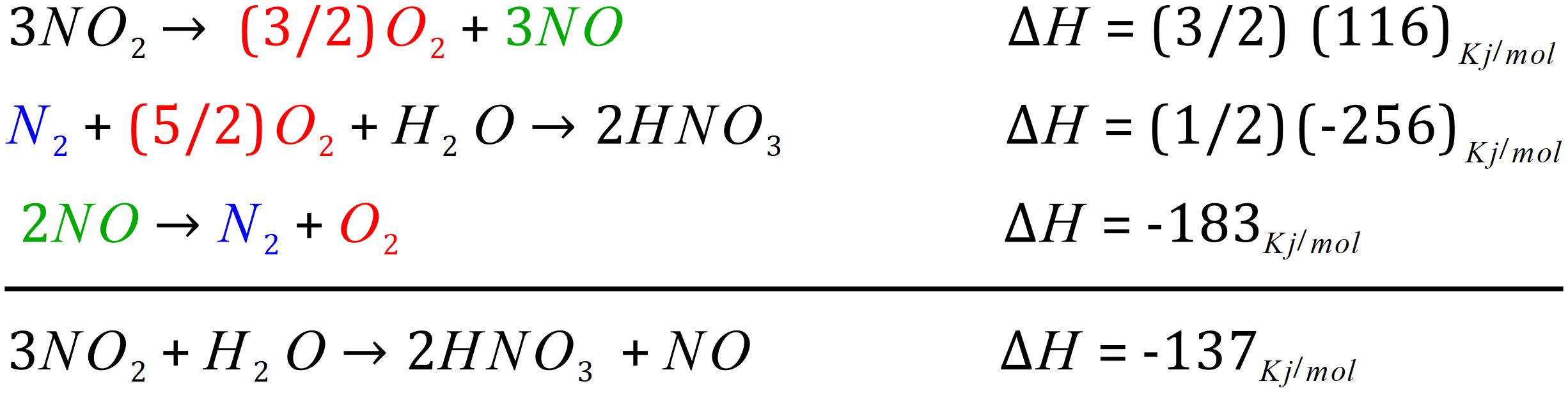
همانطور که می بینید؛ المان های همرنگ از هم کم شده و واکنش نهایی از حاصل جمع سه واکنش بالا به دست آمده است.