نقطه آغاز یادگیری استوکیومتری، داشتن درک صحیح از یک واکنش شیمیایی است. اگر با بنیان و مفهوم معادله واکنش آشنایی نداشته باشید؛ قطعا استوکیومتری را نیز نخواهید دانست و به دنبال آن هیچ درک صحیحی از شیمی نخواهید داشت.
برای حل این مساله بیایید به سراغ یک واکنش شیمیایی برویم و با آن شروع کنیم.
یک واکنش شیمیایی چیست و چه چیزی را نشان می دهد؟
برای دانستن جواب این سوال باید به سراغ یکی از مفاهیمی برویم که همه شما آن را می دانید. بحث پایستگی جرم و انرژی. همه ما می دانیم که انرژی در طبیعت به وجود نمی آید و از بین نمی رود بلکه از حالتی به حالت دیگر تغییر می کند.
دقیقا عبارتی برای ماده نیز داریم که بیان می کند ماده از بین نمی رود و تولید نمی شود؛ بلکه از حالتی به حالت دیگر تغییر می کند. به عنوان یک مثال ساده، وقتی بنزین می سوزد، اتم های سازنده بنزین از بین نمی روند؛ بلکه از حالت مولکولی بنزین به حالت مولکولی آب و کربن دی اکسید تغییر می کنند.
در طی این تغییر اتم های کربن و اکسیژن و هیدروژن هیچ تغییری نمی کنند؛ صرفا از هم جدا شده و به نحوه ای دیگر دوباره به هم وصل می شوند تا مولکول های فرآورده را تولید کنند.
این نگرش باعث می شود تا یک نتیجه ساده و سر راست داشته باشیم و آن این که، طی یک واکنش شیمیایی، باید مجموع وزن واکنش دهنده ها با مجموع وزن فرآورده ها برابر باشد. پس باید روابطی وجود داشته باشد تا بتوانیم این توازن را ایجاد و مطالعه کنیم.
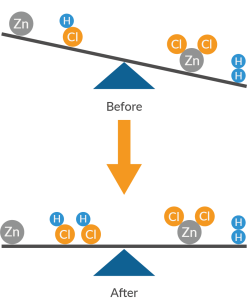
پس باید روابطی بین مواد واکنش دهنده و فرآورده وجود داشته باشد تا برقراری اصل پایستگی ماده را تامین کند. ما این روابط را در قالب استوکیومتری مطالعه می کنیم. اولین گام برای یادگیری استوکیومتری، یادگیری موازنه است. موازنه به ما کمک می کند تا به نسبت های دقیقی دست پیدا کنیم که مواد با آن نسبت ها با هم وارد واکنش می شوند و فرآورده ها را ایجاد می کنند.
اما پیش از آن باید با مفهومی به نام مول آشنا شویم.
مول چیست؟ از کجا آمده است؟
برای فهم و درک یک واکنش شیمیایی ما نیاز داریم تا سیستم محاسباتی ایجاد کنیم تا همه مواد را در آن سیستم مطالعه کنیم. این سیستم باید به نحوی باشد که با استفاده از آن بتوان در مورد هر واکنش دهنده ای محاسبات انجام داد، در حالی که هر یک از آن ها جرم متفاوتی دارد.
به عنوان مثال، فرض کنید من می خواهم درباره واکنش زیر صحبت کنم.
اگر فرض کنیم که یک گرم هیدروژن و یک گرم اکسیژن واکنش داده باشند؛ پس حتما دو گرم آب تولید می شود. این چیزی است که با دیدن این واکنش و با دانستن قانون پایستگی جرم به ذهن می رسد؛ اما این اشتباه است. اما چرا؟
بیایید فرض کنیم که یک مولکول هیدروژن () بخواهد با یک مولکول اکسیژن (
) واکنش دهد و یک مولکول آب (
) ایجاد کند. بنابراین، دو اتم هیدروژن و دو اتم اکسیژن از هم جدا شده و به شکل دیگری به هم می چسبند. در این صورت هر دو اتم هیدروژن در محصول (آب) وجود دارند؛ اما فقط یکی از اتم های اکسیژن مصرف می شود.
پس تکلیف اتم اکسیژن دیگر چه می شود؟ اینجا جایی است که ما باید متوقف شویم و به سراغ همان سیستم برویم. این سیستم همان مول است.
مول چیست و از کجا آمده است؟
برای اولین بار، آمادئو آووگادرو سعی کرد تا تعداد مولکول های هیدروژن موجود در یک گرم هیدروژن را شمارش کند. او با انجام یک سری محاسبات به عددی رسید که بعد ها به افتخار خود او به نام عدد آووگادرو شناخته و معروف شد. هر یک عدد آووگادرو معادل با ذره از آن ماده است.
بعد ها این عدد به عنوان یک استناندارد جهانی شناخته شد و بنا بر این گذاشته شد که هر یک عدد آووگادرو از هر ماده ای را یک مول از آن ماده بنامند. بر این اسا حالا سیستمی داریم که فارغ از جرم، برای همه مواد قابل استفاده می باشد.
آنچه در یک واکنش رخ می دهد، در واقع تعامل بین مول های مواد واکنش دهنده برای ایجاد مول های فرآورده است. ما در یک واکنش شیمیایی، تعداد مول های شرکت کننده از هر ماده را پیش از نماد شیمیایی آن ماده و به صورت یک ضریب صحیح می آوریم و به آن ضریب استوکیومتری می گوییم.
یک ضریب استوکیومتری در حقیقت تعداد مول هایی از آن ماده است که در واکنش مورد نظر شرکت می کند. بر این اساس برای همان واکنش تولید آب از هیدروژن و اکسیژن داریم:
حالا با این ضرایب، می توانیم بگوییم که برای تشکیل دو مولکول آب، یک مولکول اکسیژن و دو مولکول هیدروژن نیاز است. و همانطور که مشاهده می کنید؛ هیچ اتمی اضافه نیست و حالا می توان با داشتن جرم مولی هر یک از مواد، به طور دقیق حساب کرد که به ازای چه مقداری از مواد اولیه، چه مقدار محصول تولید خواهد شد.
موازنه واکنش، در یک کلام یعنی، پیدا کردن تناسب بین مواد اولیه و فرآورده ها.
چگونه یک واکنش را موازنه کنیم؟
برای موازنه یک واکنش مراحل زیر را به ترتیب دنبال کنید:
1_ معادله واکنش را به طور دقیق بنویسید.
یعنی بنویسید که چه موادی با هم واکنش می دهند و چه موادی را تولید می کنند. به عنوان مثال:
2_ پیچیده ترین ماده (خواه در واکنش دهنده ها باشد یا در فرآورده ها) را انتخاب کنید و به آن ضریب 1 را نسبت دهید.
پیچیده ترین ماده یعنی، ماده ای که بیشترین تعداد عناصر را در خودش دارد. در این مثال، سدیم تری فسفات، اتم های فسفر، اکسیژن و سدیم را در خود دارد و در سمت فرآورده ها، فسفریک اسید، اتم های اکسیژن، هیدروژن و فسفر را در خود دارد.
این ها هر کدام 3 اتم مختلف دارند در حالی که سدیم کلرید و هیدروکلریک اسید، هر کدام 2 عنصر در خودشان دارند. پس فسفریک اسید و یا سدیم تری فسفات، مواد پیچیده تری (به لحاظ فرمول شیمیایی) نسبت به سایر مواد هستند. پس یکی از آن ها را انخاب کرده و به آن ضریب 1 را نسبت می دهیم؛ پس داریم:
3_ یکی یکی اتم های ماده ای که به آن ضریب 1 را نسبت دادیم موازنه می کنیم. به نحوی که تعداد اتم های هر عنصر در دو طرف واکنش برابر شود.
در مورد این مثال، در ماده سدیم تری فسفات، سه اتم سدیم در سمت چپ واکنش داریم؛ پس باید سه اتم سدیم هم در سمت راست داشته باشیم؛ بر این اساس، ضریب سدیم کلرید، باید 3 باشد. پس داریم:
اتم بعدی فسفر یا اکسیژن است؛ من فسفر را بررسی می کنم، در سمت چپ واکنش فقط 1 اتم فسفر داریم پس در سمت راست نیز باید تنها 1 فسفر داشته باشیم. پس به فسفریک اسید، ضریب 1 را نسبت می دهم تا این توازن برقرار شود. بنابراین داریم:
خب، در این مرحله، دیگر اتمی از ماده سدیم تری فسفات باقی نمانده تا آن را موازنه کنیم؛ بنابراین به سراغ ماده دیگری که ضریب آن مشخص شده می رویم و به موازنه اتم های آن می پردازیم. ما می توانیم بین سدیم کلرید و فسفریک اسید یکی را انتخاب کنیم؛ من سدیم کلرید را انتخاب می کنم.
در سمت راست واکنش برای سدیم کلرید، از قبل تعداد اتم سدیم را موازنه کرده ایم؛ پس به سراغ کلر می رویم؛ با توجه به ضریب 3 پشت سدیم کلرید، سه اتم کلر وجود دارد. پس باید در سمت راست واکنش نیز سه اتم کلر وجود داشته باشد. بنابراین برای هیدروکلریک اسید، ضریب 3 را می نویسیم تا این توازن برقرار شود. پس داریم:
4_ در پایان، چک کنید که تعداد اتم های هر عنصر، در دو طرف معادله برابر باشد.
در حال حاضر در سمت واکنش و سمت چپ تعداد اتم ها به صورت زیر است:
| سمت چپ | سمت راست | |
| P | 1 | 1 |
| H | 3 | 3 |
| O | 4 | 4 |
| Cl | 3 | 3 |
| Na | 3 | 3 |
بنابراین واکنش به درستی موازنه شده است. در مقاله ای دیگر، به بررسی مثال های پیچیده تر می پردازیم.