دیاگرام های لاتیمر, که توسط شیمیدان آمریکایی وندل میچل لایتیمر به دنیا معرفی شد ,در واقع ارتباط حالات مختلف اکسایش یک عنصر را با نمایش پتانسیل کاهش استاندارد تبدیل آنها به یکدیگر, به صورت خلاصه بیان می کند .برای فهم بیشتر ابتدا به تعریف “واکنش تسهیم نامتناسب “بین حالات مختلف اکسایش عناصر می پردازیم : وقتی یک جسم بتواند در سه درجه اکسایش یا بیشتر وجود داشته باشد همیشه این احتمال وجود دارد که نمونه ای که دارای درجه اکسایش وسط است ناپایدار باشد. در این صورت قسمتی از نمونه با درجه اکسیداسیون وسط به یک نمونه با درجه اکسیداسیون بالاتر اکسید و بقیه به نمونه با درجه اکسیداسیون کمتر احیا می شود چنین واکنشی یک”تسهیم نا متناسب “نامیده می شود.
درک ارتباط بین درجات مختلف اکسیداسیون یک عنصرو واکنش تسهیم نامتناسب احتمالی که آنها را شامل می شوند به وسیله “دیاگرام های لاتیمر” نمایش داده می شود.
به عنوان مثال در مورد پراکسید هیدروژن (که درجه اکسیداسیون اکسیژن در آن آن (1-)است)تسهیم نامتناسب داریم به اکسیژن مولکولی(با درجه اکسیداسیون صفر) و آب (با درجه اکسیداسیون (2-)).
دیاگرام لاتیمر طرحی برای خلاصه کردن این اطلاعات است :
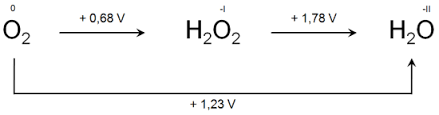
دیاگرام لاتیمر برای اعداد اکسایش اکسیژن
طبق قرارداد نمونه دارای بیشترین درجه اکسیداسیون در منتهی الیه سمت چپ نشان داده میشود.
از پتانسیل الکترود ها می توان به منظور مشخص کردن تمایل عنصر با درجه اکسیداسیون وسط به تسهیم نامتناسب استفاده کرد .
برای این کار نیم پیل های مربوط به واکنش های اکسیداسیون و احیای عنصر وسط را به دست می آوریم ,در صورتی که پتانسیل استاندارد پیل مثبت باشد, نشان دهنده این موضوع است که تسهیم نامتناسب Bبه A و Cاتفاق می افتد و در غیر این صورت در حد چشمگیری نمی تواند اتفاق بیفتد.
در واقع با توجه به اینکه مقادیر پتانسیل استاندارد نشان داده شده در دیاگرام لاتیمر مقیاسی برای سنجش میزان تمایل انجام یک واکنش به سمت راست است ,می توان گفت وقتی بزرگتر از
,از در در این صورت تمایل تبدیلB بهC بیشتر ازAبهB است ولی به هر صورت تصمیم نامتناسب اتفاق می افتد اما اگر
بزرگتر از
, در این صورت تمایل تبدیلA بهB بیشتر ازB بهC است در این صورت تسهیم چندانی نمی تواند اتفاق بیفتد.
علاوه بر کاربرد تسهیم نامتناسب و تمایل تغییر عدد اکسایش عناصر در واکنش های خودبه خودی که گفته شد , یکی دیگر از کاربرد های نمودار لاتیمر به دست آوردن پتانسیل استاندارد یک سری از واکنش ها با استفاده از پتانسیل استاندارد واکنش هایی است که حاصل جمع آنها به واکنش مجهول می رسد .
در مثال های زیر پتانسیل استاندارد واکنش های مربوط به فلش های فرعی با استفاده از روابط مربوط به پتانسیل استاندارد و انرژی آزاد استاندارد قابل اندازه گیری هستند :
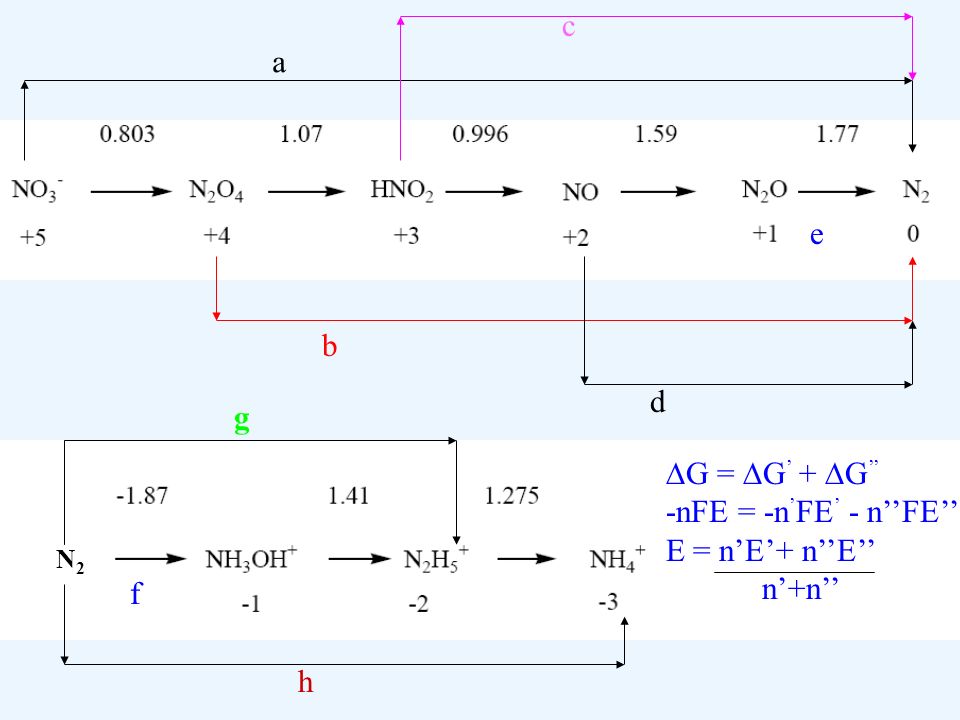
دیاگرام لاتیمر نیتروژن
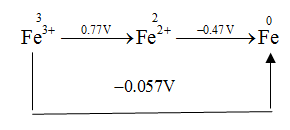
استفاده از دیاگرام لاتیمر برای محاسبه پتانسیل استاندارد