مفهوم بافر در شیمی وطبیعت
فرض کنید ما در محیطی زندگی میکردیم که هر زباله ای توسط موجودات تولید می شد ،از بین نمی رفتند. مثلا گازهای کربن دی اکسید حاصل از تنفس موجودات ،توسط گیاهان طی چرخه ی کربن دوباره به اکسیژن تبدیل نمی شدند.
در مقیاس دیگر که مثلا بدن انسان و یا محیط یک محلول هست هم مشابه همین رفتار است.
فرض کنید نوشیدن یک لیوان شربت آبلیمو باعث شود اسیدیته خون شما به شدت بالا برود و روی عملکرد تمام ارگان های بدن تاثیر منفی بگذارد چرا چون در بدن سیستمی وجود ندارد که تعادل اسیدیته خون رو تنطیم کند.
ولی در واقعیت این اتفاق نمی افتد، سوال اینجاست که چه سیستمی وجود دارد که این کارتنظیم پی اج محیط خون را انجام می دهد؟
در این مقاله می خواهیم راجع به سیستم بافر صحبت کنیم.

بافر چیست؟
محلول بافر محلولی است که
در برابر تغییرات PH مقاومت میکند و اگر مثلا چند قطره اسید یا باز به محیط
اضافه شود، PHمحلول تغییر
محسوسی نخواهد کرد .
بهترین مثال برای بافر ، خون هست که پی اچ آن حدود 7.4 و خنثی است.
پی اچ خون به وسیله سیستم بافر ، سیستم تنفسی و سیستم کلیوی تنظیم می شود.
مثلا وقتی که ورزش میکنیم در ماهیچه ها و عضلات ما لاکتیک اسید تولید می گردد و وارد جریان خون می شود در خون کربنیک اسید و یون بی کربنات وجود دارد که همان نقش اسید ضعیف و نمک را دارد و با استفاده از آنزیم دیگری کربنیک اسید به دی اکسید کربن و آب شکسته و از بدن خارج می شود پس در اینجا هم محلول بافر خون و هم تنفس و تعریق به تنظیم پی اچ کمک می کند.
پس می توان بافر را محلولی شامل اسید ضعیف و نمک آن و یا باز ضعیف به همراه نمک آن نیز تعریف کرد که در برابر تغییرات پی اچ مقاوم است .
اما بافر نیز حد و ظرفیتی دارد...
مثلا بدن شما با نوشیدن یک لیوان شربت آبلیمو مشکلی ندارد اما اگر این مقدار یک لیتر شود دیگر از سیستم بافر هم کاری بر نمی آید.
"وجود اسید بیش از حد در مایعات بدن می تواند عامل پوکی استخوان ،آرتریت ،دیابت، سکته مغزی، بیماری قلبی ، ام اس و سرطان شود و از سوی دیگر کاهش محیط قلیایی موجب تهوع ، التهاب و رفلاکس می شود."
پس محلول های بافر دارای ظرفیت محدودی هستند برای اینکه مقدار پی اچ راثابت نگه دارند واگر بیش از اندازه باز اضافه کنیم تاثیر اسید ضعیف از بین میرود و یا اسید به محلول وارد شود باز ضعیف از بین می رود و فعالیت بافر متوقف می شود.
سیستم بافر از قانون لوشاتلیه پیروی میکنه
اصل لوشاتلیه بیان میکند : اگر عاملی موجب بر هم زدن یک
سامانه ی تعادلی شود،سامانه در جهتی جابه جا می شود که با عامل مزاحم مقابله کرده
و تا آنجا که امکان دارد اثر آن را تعدیل کند.
علت اینکه از اسید و باز ضعیف در محلول بافر استفاده می شود این است که در واکنش تفکیک اسید یا بازضعیف ،این معادله تعادلی است و قابل برگشت اما در اسید قوی یا باز قوی معادله یک طرفه و برگشت ناپذیر است و می دانیم که بافرها موادی هستند که قابلیت اتصال برگشت پذیر به یون هیدروژن را دارند.
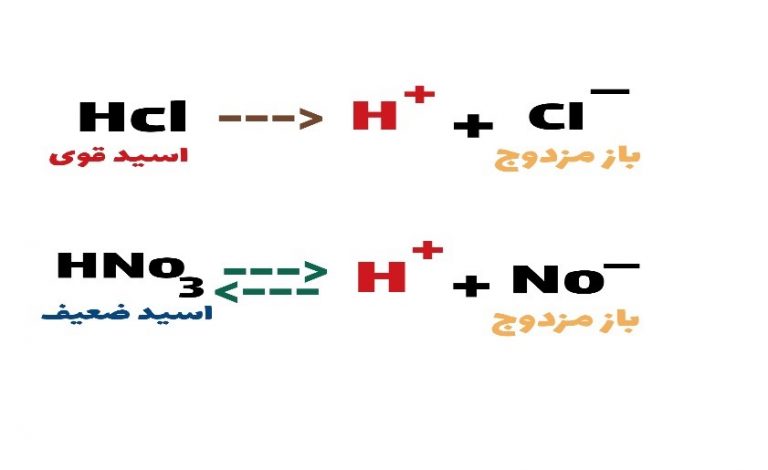
برای تعیین پی اچ محیط های آبی حاوی بافر از معادله هندرسن هاسل باخ استفاده می شود که نحوه ی اثبات این فرمول در معادله زیر آورده شده است
HA --->H + A


کاربرد محلول های بافر در صنعت و شیمی تجزیه بسیار زیاد است و به عبارتی بخش مهمی از بسیاری فرآیند های صنعت مثلا به منظور فرآیندهای تخمیری و تنظیم شرایط صحیح رنگ ها در نساجی و همچنین در آبکاری و تهیه چرم و مواد عکاسی از محلول بافر استفاده می کنند،
در پژوهش های باکتری شناسی برای حفظ پی اچ لازم جهت رشد باکتری مورد مطالعه، معمولا محیط کشت را بافری میکنند ،در تیتراسیون های اسید و باز و کالیبره کردن پی اچ سنج ها از محلول های بافر استفاده می کننددر کل بافر ها در شیمی تجزیه صنعت و طبیعت بکار میروند .