مفهوم تعادل چیست؟
مفهوم تعادل چیست؟
زمانی میتوانیم بگوییم شرایط واکنش تعادلی است که سرعت واکنش های رفت با برگشت با هم برابر باشند یا به عبارتی واکنش دهنده ها و فرآورده ها پس از گذشت زمان تغییر نکنند و تغییری دیگر در خواص سیستم مشاهده نشود.
برای درک بهتر مفهوم تعادل در واکنش های شیمیایی ، مناسب تر است که برقراری تعادل برای واکنش شیمیایی در ظرف در بسته در نظر گرفته شود که با تغییر رنگ همراه باشد.
واکنش های شیمیایی با توجه به تغییر آنتالپی و تغییر آنتروپی به دو دسته ی واکنش های برگشت پذیر و برگشت ناپذیر تقسیم می شوند:
واکنش های شیمیایی
این واکنش ها به دو دسته تعادلی و غیرتعادلی تقسیم میشوند:
مثال
تعادلی
CaCO3(s) ↔ CaO(s) + CO2(g)
در ظرف در بسته R1=R2
غیر تعادلی
CaCO3(s) → CaO(s) +CO2(g)
در ظرف در باز
واکنش برگشت پذیر:
واکنش هایی هستند که تنها یک عامل مساعد در پیشرفت خود به خودی را در یک جهت و عامل مساعد دیگر را در جهت مخالف دارند یعنی در هر دو جهت خود به خود پیش میروند پس دو طرفه است.
مثال از واکنش های برگشت پذیر
بسیاری از واکنش های شیمیایی در طبیعت برگشت پذیرند
N2(g) + 3H2(g) ↔ 2NH3(g) + q(گرما)
واکنش برگشت ناپذیر:
واکنش هایی هستند که هر دوعامل مساعد در پیشرفت خود به خودی یعنی کاهش آنتالپی،افزایش آنتروپی در جهت رفت به وقوع می پیوندند پس چنین واکنش هایی نمی توانند در جهت برگشت پیش بروند پس یک طرفه هم نامیده می شوند.
مثال از واکنش های برگشت ناپذیر
پختن غذا
رسیدن میوه
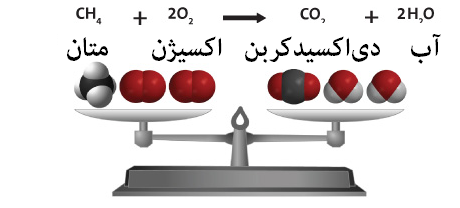
سوختن هیدروکربن ها
2C2H6 (g) + 7O2(g)→ 4CO2 (g) +6H2O(g) + q
مبنای درک واکنش های تعادلی تعادلی این است که ما واکنش های برگشت پذیر را بشناسیم. اگر در یک واکنش برگشت پذیر در شرایط نامناسب، سرعت واکنش های رفت و برگشت برابر شود به آن واکنش ، تعادلی گفته می شود.
پس میتوان گفت واکنش های تعادلی زیر مجموعه ای از واکنش های برگشت پذیر هستند.
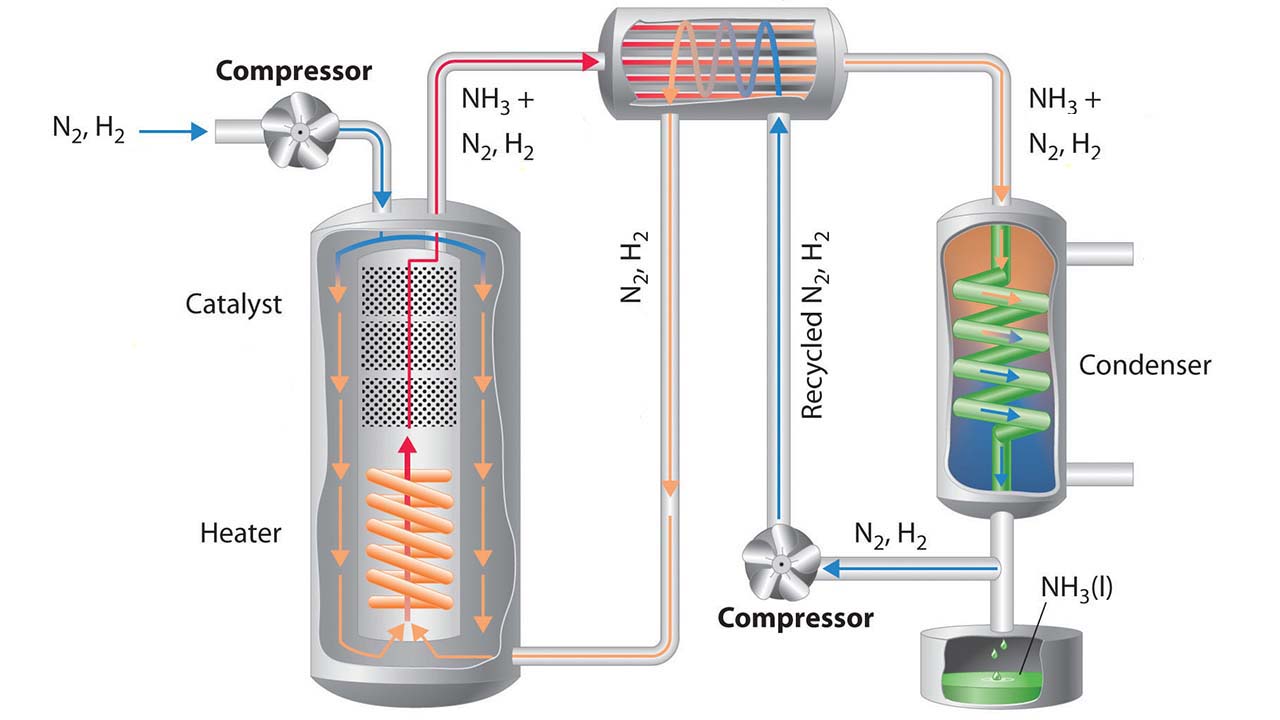
کاربرد واکنش های تعادلی در صنعت
یکی از مهمترین کاربرد های این واکنش ها در استفاده از فرآیند هابر برای تولید آمونیاک است
آمونیاک ماده ی پرارزشی است که در تهیه ی کودهای شیمیایی ، مواد منفجره و مواد شیمیایی صنعتی _تجاری بسیاری به کار می رود .
طی سالیان متمادی دانشمندان سعی می کردند که این ماده را از نیتروژن و هیدروژن تهیه کنند اما بالاخره دانشمندی به نام هابر موفق شد از طریق این واکنش تعادلی آمونیاک را در مقیاس آزمایشگاهی تولید کند و نام این فرآیند به افتخار نام وی به فرآیند هابر معروف شد.
N2 +3H2 → 2NH3(g)
در صنعت،آمونیاک را در دمایی حدود 550 درجه سانتی گراد و فشاری برابر با 150 تا 350 اتمسفر در مجاورت آهن و اکسید های فلزی مانند MgOوAL2O3تهیه میکنند.