تماس با ما 02171058519
چگونه R یا S بودن (پیکربندی) یک مرکز کایرال را تعیین کنیم؟
پیش تر در مقاله ای جداگانه به بررسی کامل مفهوم فعالیت نوری و کایرال بودن یا نبودن ترکیبات پرداختیم. در این مقاله قصد داریم تا درباره پیکربندی مرکز کایرال و چپ گرد و یا راست گرد بودن آن ها صحبت کنیم.
پیش از هر چیزی باید بدانید که R و یا S بودن یک مرکز کایرال به این معنی نیست که ترکیب مورد نظر در محیط شیمیایی حلال فقط به راست یا فقط به چپ می چرخد. هر مولکول می تواند در سه بعد فضایی چرخش داشته باشد و R و یا S بودن ربطی به این موضوع ندارد.تعیین پیکربندی مولکول های کایرال (R و یا S بودن) صرفا برای این است که ما بتوانیم ایزومر ها را از هم تشخیص دهیم و کاربرد خاصی ندارد.
چگونه می توان پیکربندی یک مولکول کایرال را تعیین کرد؟
برای تعیین پیکربندی مولکل کایرال، نیاز است تا قدم های زیر را یک به یک پیش بروید. اما پیش از آن باید با رسم مولکول ها به فرم فیشر آشنا شوید. همانطور که می دانید؛ ما می توانیم مولکول ها را به شکل های مختلفی رسم کنیم. از جمله این شکل ها، می توان به فرم لوئیس، فرم گوی و میله ای و… اشاره کرد.
چگونه مولکول ها را به فرم فیشر رسم کنیم؟
فرم فیشر نوع دیگری از روش های نشان دادن مولکول به صورت سه بعدی است. در این شیوه ما یک سری گروه های عاملی را خارج از صفحه و به سمت خودمان و یا به سمت مخالف خودمان در نظر گرفته و با رسم خطوط عمودی و افقی آن ها را نمایش می دهیم. در فرم فیشری، مولکول را بر روی یک علامت + رسم می کنیم.
همانطور که ملاحظه می کنید؛ روی علامت + (علامت به اضافه ریاضی) دو خط وجود دارد که یکی افقی و دیگری عمودی است. خط عمودی از بالا به پایین و خط افقی از چپ به راست رسم شده است. در این فرم، چنین توافق شده که هر گروهی که روی خط افقی قرار داشته باشد را به صورت خارج شده از صفحه و به سمت خودمان تصور کنیم و هر گروه موجود بر روی محور عمودی را خارج شده از صفحه و دور شده از خودمان ببینیم. برای درک بهتر به رسم مولکول فرضی زیر دقت کنید.
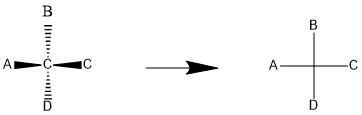
همانطور که مشاهده می کنید؛ در این مولکول فرضی کربن به عنوان اتم مرکزی انتخاب شده و اتم های A و B و C و D، اتم های فرضی متصل به آن هستند. اتم کربن مرکزی بر روی صفحه کاغذ و گروه های A و C از صفحه خارج شده و به سمت ما جهت گیری کرده اند و گروه های B و D از صفحه خارج شده و به سمت درون صفحه جهت گرفته اند.
در سمت راست فرم گوه ای و سمت راست فرم فیشری این مولکول فرضی را نشان می دهد. همین فرم را می توان برای همه مولکول های دیگر نیز رسم کرد. تنها شرط این است که به اتم مرکزی، چهار اتم یا گروه عاملی متصل باشد. چون در فرم فیشری، ما هیچ گروه عاملی موازی بر روی صفحه نداریم؛ به جز اتم مرکزی که خودش روی صفحه در نظر گرفته می شود؛ سایر گروه ها خارج از صفحه واقع شده اند.
حالا که فرم فیشر را یاد گرفته اید؛ بیایید به تعیین R و یا S بودن مولکول ها بپردازیم. برای این کار، ما باید قدم های زیر را دنبال کنیم:
1_ چهار گروه عاملی را دور اتم مرکزی قرار دهید و مطابق با قواعد زیر، به آن ها اولویت های 1 تا 4 را نسبت دهید.
الف) بالاترین اولویت (اولویت شماره 1) مربوط به اتمی است که سنگین تر باشد (عدد اتمی بزرگتری داشته باشد). اگر به دو گروه برخوردیم که اتم های مشابه باشند؛ گروهی اولویت بالاتری دارد که بعد از اتم اول، به اتم یا گروه سنگین تری متصل باشد. این سنگین تر بودن می تواند اتم سنگین تر یا زنجیره و یا گروه عاملی بزرگتر و سنگین تر باشد.توجه داشته باشید که گروه سنگین تر، گروهی است که در مجموع سنگین تر باشد. یعنی مجموع وزن کل گروه سنگین تر باشد.
ب) مولکول را به نحوی قرار می دهیم که اتم یا گروه با اولویت 4 (سبک ترین) در پشت مولکول قرار گیرد.
2_ سه گروه عاملی دیگر را در نظر بگیرید و سپس از بالاترین اولیوت به پایین ترین اولیویت حرکت کنید. حال اگر جهت حرکت در راستای چرخش عقربه های ساعت بود، پیکربندی R و در صورتی که چرخش در خلاف جهت چرخش عقربه های ساعت بود؛ پیکربندی S خواهد بود.
برای تعیین پیکربندی بهتر است ابتدا مولکول را به فرم فیشری اش تبدیل کنید. حالا گروه های اطراف را به نحوی قرار دهید تا سنگین ترین گروه عاملی در موقعیت عمودی قرار بگیرد. سپس قدم های بالا را طی کنید. بیایید مثال حل کنیم.
پیکربندی مولکول های زیر را تعیین کنید؟
ابتدا مولکول داده شده را به فرم فیشری تبدیل می کنیم.

مولکول را اولویت گذاری می کنیم و جهت چرخش را تعیین می کنیم:
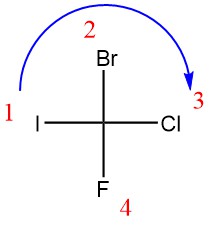
با این حساب، پیکربندی این مولکول R است.
یک سری جزئیات در مورد تعیین پیکربندی مرکز کایرال مولکول ها وجود دارد که در ادامه به آن اشاره می کنیم:
1_ اولویت چهارم همیشه باید در موقعیت عمودی باشد.
2_ اگر روی مرکز کایرال جفت الکترون ناپیوندی باشد؛ همیشه اولویت چهارم به آن تعلق دارد.
3_ اگر در فرم فیشری اولویت چهارم در موقعیت افقی باشد؛ پیکربندی را مشخص کرده سپس آن را برعکس می کنیم. یعنی اگر پیکر بندی R بود آن را S و اگر S بود آن را R گزارش می کنیم.
4_ اگر جای دو گروه روی مرکز کایرال را عوض کنیم؛ پیکربندی برعکس می شود.
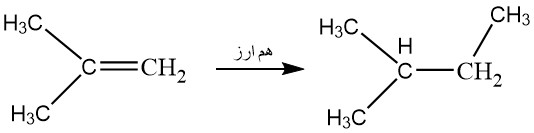
5_ اگر به گروه مورد نظر ما پیوند دوگانه کربن – کربن متصل باشد؛ آن را به صورت دو گروه متیل در نظر می گیریم. به همین نحو درباره سایر پیوند های دوگانه نیز به همین شکل عمل می کنیم. یعنی اتم متصل به پیوند دوگانه را دو بار حساب می کنیم. برای درک بهتر به تصویر زیر توجه کنید.
به این پست چند تا ستاره میدی؟
برای امتیاز دهی روی ستاره ها کلیک کن
امتیاز میانگین 4.6 / 5. تعداد رای ها 24










یک نظر در “چگونه R یا S بودن (پیکربندی) یک مرکز کایرال را تعیین کنیم؟”
بهترین توضیحی که تا به حال در مورد کنفیگوراسیون R و S خواندم. ممنونم