شرح مختصر جدول تناوبي:
لاوازيه دانشمند فرانسوي، اولين كسي بود كه عناصر را طبقه بندي نمود.
او عناصر را به دو دسته كلي تقسيم كرد. دسته اول، عناصري كه در تركيب با اكسيژن، اسيدها را به وجود مي آورند، عناصر غيرفلزي و دسته دوم كه در واكنش با اكسيژن چنين خصلتي ندارند، عناصرفلزي نام گرفتند.
برزيليوس براساس نظريه الكتروشيميايي، عناصر را به دو دسته فلزات و غيرفلزات تقسيم بندي كرد.
مندليف 60 عنصر را برحسب افزايش وزن اتمي طبقه بندي نمود و متوجه شد كه عناصر مشابه با خواص شيميايي مشابه در كنار يكديگر قرار ميگيرند.
خواص تناوبي عنصرها با توجه به محل آنها در جدول تناوبي و بررسي تغييرات كلي اين خواص:
آرايشهاي الكتروني اتمها يك تغيير تناوبي را با افزايش عدد اتمي (بار هسته) به نمايش ميگذارند. اين خواص، كه به طور تناوبي در جدولي كه بر حسب عدد اتمي مرتب شده است تكرار ميشود، به ترتيب مرتب شدن لايههاي كوانتايي تغيير ميكنند.
به طور كل:
در جدول تناوبي، آن دسته از عناصر كه تعداد لايههاي مجاز الكتروني آنها با هم برابر و عدد كوانتومي اصلي لايه ظرفيت آنها يكسان باشد، يك دوره را در جدول تناوبي تشکیل می دهند.
در هر دوره تناوبي،با پرشدن لايههاي الكتروني كوانتايي نهايتا آرايش الكتروني به صورت s2p6 درآمده و به آرايش و ساختمان يك گاز بياثر ختم ميشود.
عناصري كه آرايش الكتروني يكسان در لايه ظرفيت خود داشته باشند، در جدول تناوبي تشكيل يك گروه را داده و در زير هم و در يك ستون قرار ميگيرند.
بار مؤثر هسته و نحوه محاسبه آن:
در اتم هاي چند الكتروني، بار منفي هر الكترون، مقداري از بار مثبت آن اتم را خنثي كرده و از تاثير تمام بار مثبت هسته، بر الكترونهاي باقيمانده، ميكاهد. اين تاثير را اصطلاحاً اثر پوششي مينامند.
مقداري از بار مثبت هسته كه پس از تاثير اثر پوششي الكترونهاي پوشش دهنده، از بار حقيقي هسته اتم براي الكترون مورد نظر باقي ميماند، بار موثر هسته ناميده مي شود.
در كل، هر چه اثر پوششي بيشتر باشد، بار موثر هسته، يعني باري كه واقعا باعث جذب الكترونهاي مدار خارجي مي شودكمتر خواهد شد.
رابطه زير ارتباط بين عدد اتمي و بار موثر هسته را نشان مي دهد s ثابت پوششي الکترون های ترازهاي پايينتر، z عدد اتمي و *z بار موثر هسته اتم مورد نظر است.
Z* = Z – S
نحوه محاسبه بار موثر هسته:
الف) روش اسليتر:
قواعد اسليتر را براي محاسبه اثر پوششي بصورت زير مي توان مرتب کرد
اگرالكترون مورد نظر در ترازهاي s يا p قرار داشته باشد :
1- الكترونهاي موجود در لايههاي الكتروني را به صورت زير مرتب مي كنيم:
(1s), (2s,2p), (3s,3p), (3d), (4s,4p), (4d), (4f), (5s,5p),…
2- براي تمام الكترونهايي كه نسبت به الكترون مورد نظر در تراز انرژي بالاتري هستند، ثابت پوششي برابر صفر است.
3- براي هر يك از الكترونهاي ns و np ثابت پوششي = s
n 0.35 است(اين ثابت براي الكترونهاي موجود در اوربيتال 1s، برابر 3/0 است).
4- هر يك از الكترونها در ترازهاي (n-1) ، داراي ثابت پوششي برابر 85/0 = s ميباشند.
5- هر يك از الكترونها در ترازهاي (n-2) و يا پايين تر داراي ثابت پوششي s = 1 ميباشند.
اگر الكترون مورد نظر در تراز d و يا f باشد، قواعد زير را در نظر ميگيريم:
1- براي هر الكترون موجود در تراز d ويا f، ثابت پوششي برابر s = 0.35 است.
2- براي الكترونهاي باقيمانده در ترازهاي پايينتر، ثابت پوششي s = 1 است.
ب : روش كلمانتي و ريموندي:
در این روش ثابت پوششي يكساني براي همه الكترونهاي موجود در يك تراز اصلي در نظر گرفته نميشوند و تنها براي الكترونهاي موجود در هر تراز فرعي ، ثابت پوششي ، برابر فرض مي شود ديگر اينكه، الكترونهايي كه نسبت به الكترون مورد نظر در فاصله دورتري نسبت به هسته وجود دارند نيز، در اثر پوششي دخالت داده ميشوند.
در اين روش براي هر اوربيتال در هر تراز يك رابطه رياضي در نظر گرفته ميشود:
S3s = 15.505 + 0.0971(N3s) + 0.8433(N3d) + 0.068 (N3f)
تغييرات بار موثر هسته در طول دورهها و گروههاي جدول تناوبي:
در هر دوره، كمترين بار موثر را در فلزات قليايي و بيشترين بار موثر را در گازهاي بياثر توان يافت.
همين روند در مورد عناصر واسطه هر دوره ديده ميشود، اما چندان محسوس نيست به دليل اينكه در اين عناصر لايه فرعي d موقعيت درونيتري دارد.
به طور كل، در طول هر دوره، با افزايش عدد اتمي، بار موثر هسته نيز افزايش مييابد.
در يك گروه از جدول تناوبي، با افزايش عدد اتمي، بار موثر هسته نيز افزايش مييابد.
تغيير اندازه اتمها برحسب بار موثر هسته:
اندازه يونها بوسيله نيروي جاذبهاي كه روي الكترونهاي خارجي( الكترونهاي لايه ظرفيت) از سوي بار موثر هسته وارد ميشود، تعيين ميگردد.
وارد شدن الكترونها به اربيتال هايي با اثر پوششي ضعيف مانند p، d، f باعث ميشود بار موثر هستهاي در طول يك دوره از جدول تناوبي از چپ به راست افزايش يابد و در نتيجه شعاع كاهش پيدا كند.
در هرگروه نيز از بالا به پايين الكترونهاي لايه والانس يا ظرفيت در اربيتالهايي با عدد كوانتومي اصلي بزرگتر يعني در اوربيتالهاي بزرگتر قرار ميگيرند، در نتيجه شعاع افزايش مييابد.
انرژي يونيزاسيون :
حداقل انرژي لازم براي خارج كردن سستترين الكترون از اتم در حالت پايه و تبديل آن به يون مثبت گازي در همان حالت پايه را « انرژي يونيزاسيون» ميگويند (IE ).
محاسبه انرژي يونيزاسيون:
الف: روش طيف بيني:
انرژي يونيزاسيون عناصر را از روي نتايج طيفي آنها ميتوان به دست آورد.
براي اين منظور ميتوان از فرمول بالمر، فركانس خطوط مشهود را بدست آورد.
mn = R ( 1 / n2 – 1 / m2 )
در اين فرمول « n » تراز ظرفيت و « m » تراز بي نهايت است. « R » ثابت ريدبرگ است. و با توجه به فرمول زير انرژي لازم جهت خارج شدن الكترون از لايه ظرفيت بدست ميآيد.
E = hc = h
× 109678 × z2( 1 / n2 – 1 / m2 ) = hc × 109678 (z/n)2
و يا فقط با دانستن فركانس و يا طول موج يونش، انرژي يونش را ميتوان محاسبه كرد.
ب) روش طيف بيني جرمي:
در اين روش، با سنجش يونهاي مثبت حاصل از برخورد الکترونها به چشمه یونی طیف سنج ، از يك طرف واندازهگيري انرژي الكترونها از طرف ديگر انرژي يونيزاسيون تعيين مي گردد.
ج) روش ترموديناميكي:
اين روش برمبناي قانون هس استوار است و از چرخه يا «سيكل بورن هابر» استفاده ميشود.
د) روش استفاده از بار موثر هسته :
با استفاده از بار موثر هسته و قواعد اسليتر نيز ميتوان انرژي يونيزاسيون را محاسبه كرد. در اين روش انرژي يونيزاسيون اختلاف انرژي بين اتم در حالت خنثي و يون حاصل از آن اتم ميباشد.
براي خارج كردن الكترون از حيطه جاذبه هسته اتم، بايد نيرويي اعمال شود كه بر نيروي جاذبه بين الكترون و هسته اتم غلبه كرده و آن را خنثي كند. اين نيرو كه همان انرژي يونش ميباشد.
انرژي يونيزاسيون از رابطه زير بدست مي آيد:
EI = A (Z* / n-σ)2
(σ) افت كوانتوم و (n – σ) عدد كوانتومي موثر ميباشد. n، عدد كوانتومي اصلي و يا لايه ظرفيت ميباشد، رابطه (n – σ) را با *n نمايش ميدهند:
nn* = n – σ
*n عدد كوانتومي اصلي موثر ميباشد.
براي مقادير مختلف n، عدد كوانتومي اصلي عبارت است از:
| 6 | 5 | 4 | 3 | 2 | 1 | n |
| 4.3 | 4 | 3.7 | 3 | 2 | 1 | *n |
و براي مقادير مختلف n، افت كوانتومي عبارت است از:
| 6 | 5 | 4 | 3 | 2 | 1 | n |
| 1.5 | 1 | 0.3 | 0 | 0 | 0 |
به اين ترتيب:
EI = 13.6 (Z* / n*)2
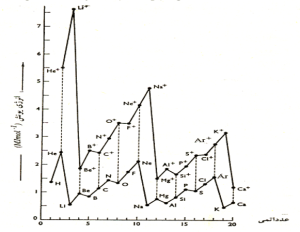
روند تغيير انرژي نخستين يونيزاسيون در جدول تناوبي:
در هر دوره از جدول تناوبي، انرژي يونش از چپ به راست افزايش مييابد. در طول هر دوره عدد كوانتومي اصلي (n) ثابت است و عاملي كه باعث اين افزايش ميگردد، افزايش عدد اتمي موثر است. انرژي نخستين يونش با مجذور عدد اتمي موثر رابطه مستقيم دارد:
EI ∝ (A/n2) (Z*)2
A/n2 براي هر دوره يك مقدار ثابت ميباشد.
روند تغييرات انرژي نخستين يونش اتمها بر حسب عدد اتمي:
در هر گروه از جدول تناوبي انرژي نخستين يونش، از بالا به پايين جدول، با افزايش عدد اتمي كاهش مييابد.
در طول هر گروه علي رقم اينكه با افزايش عدد اتمي، بارموثر هسته نيز افزايش مييابد اما در هر گروه با افزايش عدد اتمي، عدد كوانتومي اصلي (n) نيز افزايش مييابد و با توجه به اين رابطه EI = A (Z*/n*)2 و n* = n – σ ، تاثيري كه عدد كوانتومي اصلي (n) بر كاهش انرژي يونش ميگذارد بر تاثير بار موثر هسته (*Z) غلبه ميكند.
ادامه ی این مطلب را در خواص تناوبی عنصرها (2) بخوانید…
به این پست چند تا ستاره میدی؟
برای امتیاز دهی روی ستاره ها کلیک کن
امتیاز میانگین 0 / 5. تعداد رای ها 0