نظریه ی اتمی،سنگ بنای شیمی جدید است.درک ساختار اتمی و راه های برهم کنش اتم ها، محور درک شیمی است.
برای چندین دهه، پیشرفت شیمی معدنی فقط در چارچوب جدول تناوبی صورت گرفته بود، در حالیکه هیچ اطلاع دقیقی از ساختار اتم وجود نداشت. تا این که اولین بار رادرفورد اتم هسته دار را پیشنهاد کرد و در ادامه دانشمندانی چون بور، سامرفلد و شرودینگر راه را برای درک بهتر و بیشتر ساختار اتم باز کردند.البته امروزه توسعه ی شیمی معدنی نوین را به پیشرفت روش های طیف بینی نسبت می دهند.
پس بهتر است قبل از هرکاری بیشتر درمورد ساختار اتم اطلاعاتی را کسب کنیم.
اَتُم (به انگلیسی: Atom) کوچکترین مقدار یک عنصر شیمیایی است که ویژگی های آن عنصر را تعیین می کند، ما میدانیم که اتم خود از اجزای کوچکتری(الکترون،پروتون،نوترون)تشکیل شده است اما باز نیز اتم را بعنوان واحد تشکیل دهنده ی عنصر میدانیم زیرا اگر برای مثال اتم را به قطعات کوچکتری تبدیل کنیم و یک پروتون به آن بیافزاییم یا کم کنیم اتم تغییر میکند و اتم عنصر دیگری میشود.
حتی میتوانیم اتم را اینگونه نیز تعریف کرد:اتم کمترین مقدار یک عنصر است.برای مثال کمترین مقداری که از اتم آهن میتوانیم داشته باشیم ۱ اتم است. ابعاد یک اتم به اندازه ای کوچک بوده که در محدوده ی آنگستروم است. برای مثال می توان اندازه ی نقطه ی تایپ شده در پایان این جمله را از کنار هم گذاشتن یک میلیارد از اتم ها پر کرد. در مدل اتمی بور، شعاع یک اتم هیدروژن ۰.۵ آنگستروم بدست آمد.
برای نشانه گذاری اتم ها از همان علائم اختصاری که برای عناصر به کار می رفت استفاده می کنیم. برای مثال حرف C برای نشان دادن عنصر کربن و یک اتم کربن به تنهایی استفاده می شود.
الکترون
در اواخر سده ی نوزدهم، معلوم شد که خود اتم نیز ممکن است از ذرات کوچکتری تشکیل شده باشد.آزمایش های انجام شده با الکتریسیته، موجب پیدایش این تغییر دیدگاه شد.
در سال های ۱۸۰۸_۱۸۰۷ م، همفری داوی پنج عنصر(پتاسیم،سدیم،کلسیم،استرانسیم و باریم)را با استفاده از جریان الکتریسیته برای تجزیه ی اجسام، کشف کرد.این کشف بزرگ باعث شد که داوی تصور کند نیروی جاذبه ی نگهدارنده ی عناصر در اجسام، ماهیت الکتریکی دارد.
در سال های ۱۸۳۳_۱۸۳۲ م، میکائیل فاراده دست به انجام آزمایش های مهمی در الکترولیز شیمیایی فرایندهایی که در آنها ترکیبات به وسیله ی جریان الکتریسیته تجزیه می شوند، زد. فاراده رابطه ی بین مقدار الکتریسیته مصرف شده با مقدار ترکیب تجزیه شده را مطالعه کرد و قوانین الکترولیز شیمیایی را بدست آورد.جورج استونی در ۱۸۷۴ م، برمبنای قوانین فاراده پیشنهاد کرد که واحدهایی از بار الکتریکی به اتم ها وابسته اند و در ۱۸۹۱ م، پیشنهاد کرد که این واحد ها الکترون نامیده می شوند.
پروتون
بهتر است در ابتدا درمورد لوله ی پرتوی کاتدی صحبت کنیم؛ لوله ی پرتوی کاتدی لوله ای شیشه ای است که تقریبا همه ی هوای درون آن به کمک پمپ خلا خارج شده است. در دو انتهای این لوله یک قطعه فلز نصب شده است که به آن الکترود می گویند. هنگامیکه یک ولتاژ بسیار قوی بین این دو الکترود اعمال شود، پرتوهایی از الکترود منفی(کاتد) به سمت الکترود مثبت(آند) جریان می یابد. بنابراین به آنها پرتوهای کاتدی می گویند. این پرتو ها براثر برخورد با یک ماده ی فلوئورسنت، نور سبز رنگی ایجاد می کنند.
اگر یک یا چند الکترون از یک اتم یا مولکول خنثی جدا شود، باقیمانده دارای بار مثبت برابر با مجموع بار الکترون های جداشده از آن اتم یا مولکول خواهد بود. اگر دو الکترون از یک اتم نئون(نماد، Ne) جدا شود، یک یون +2 Ne تولید خواهد شد، و همین طور این ذرات مثبت(یون های مثبت)، در اثر جداشدن الکترون از اتم ها یا مولکول های موجود در گاز داخل لوله ی تخلیه الکتریکی، به علت برخورد با پرتو کاتدی تشکیل می شوند. این ذرات مثبت به سوی الکترود منفی می روند.اگر در الکترود سوراخ هایی ایجاد شود یون های مثبت از آنها می گذرند.الکترون های پرتوی کاتدی، به علت دارا بودن بار منفی، در جهت عکس(یعنی به سوی الکترود مثبت) می روند.
جریان یون های مثبت که نخستین بار توسط گلدشتاین در ۱۸۸۶ م، مشاهده شد، به پرتوی مثبت مشهور است. انحراف پرتوهای مثبت در میدان الکتریکی و مغناطیسی توسط ویلهلم وین (۱۸۹۸ م) و تامسون(۱۹۰۶ م)مطالعه شد. مقادیرq/m با استفاده از همان روش به کار گرفته شده در مطالعه پرتوی کاتدی تعیین شدند. هنگام استفاده از گاز های مختلف در لوله ی تخلیه، یون های مثبت متفاوتی به دست آمدند. در صورت استفاده از گاز هیدروژن، ذره مثبت به دست آمده، کوچکترین جرم(یعنی بالاترین نسبت q/m) را خواهد داشت. این ذرات را اکنون پروتون می نامیم جزء اصلی ساختار تمام اتم ها هستند.
پروتون ها دارای یک واحد بار مثبت(e+) است که مقدار آن برابر با بار الکترون اما با علامت مخالف است. جرم پروتون ۱۸۳۶ برابر جرم الکترون است. تعداد پروتون های اتم مشخص کننده ی نوع اتم است.
نوترون
از آنجا که اتم ها از نظر بار الکتریکی خنثی هستند، تعداد الکترون ها و پروتون ها در هر اتم باید برابر باشد. جیمز چادویک در ۱۹۳۲ م نتیجه ی تحقیقات خود را درباره ی وجود نوترون منتشر ساخت. او توانست با استفاده از داده های به دست آمده از واکنش های هسته ای معین که در آنها نوترون تولید می شد، جرم نوترون را حساب کند. چادویک با در نظر گرفتن جرم و انرژی تمام ذراتی که در این واکنش ها تولید و مصرف می شوند، جرم نوترون را که اندکی بیشتر از پروتون است به دست آورد.تعداد نوترون ها مشخص کننده ایزوتوپ عنصر است.
مدل های اتمی ارائه شده
پس از کشف الکترون و پروتون، ارائه مدل برای اتم مهم ترین مسئله دانشمندان به شمار می رفت.
مدل اتمی دموکریت
دموکریت در ۵۰۰سال قبل از میلاد اوّلین تحقیقها را در رابطه با اتم انجام داد. اصلیترین گام او در راستای تحقیق در رابطه با اتم بود.نام اتم به معنای تجزیه ناپذیر را نیز او انتخاب کرد. او بر این عقیده بود که:
*ماده ساختار ذرّهای دارد یعنی از ذرّههای بسیار کوچکی ساخته شدهاست که خود آن را میتوان تجزیه ناپذیر نامید.
*اتم مواد مختلف در شکل بایکدیگر متفاوت است. برای مثال مواد تیز و برنده یا ترش دارای اتمی با لبههای تیز به شکلهایی چون مثلث هستند یا مواد نرم و شیرین دارای شکلی دایرهای است. (البته این مورد در نظرات بعدی کاملاً رد شده)
مدل اتمی دالتون
نظریهٔ اتمی دالتون: جان دالتون نظریه اتمی خود را با اجرای آزمایش در هفت بند بیان کرد.
*ماده از ذرههای تجزیه ناپذیری به نام اتم ساخته شدهاست.
*همهٔ اتمهای یک عنصر، مشابه یکدیگرند.
*اتمها نه به وجود میآیند و نه از بین میروند.
*همهٔ اتمهای یک عنصر جرم یکسان و خواص شیمیایی یکسان دارند.
*اتمهای عنصرهای مختلف به هم متصل میشوند و مولکول ها را به وجود میآورند.
*در هر مولکول از یک ماده مرکب معین، همواره نوع و تعداد نسبی اتم های سازنده ی آن یکسان است.
*واکنشهای شیمیایی شامل جابهجایی اتمها یا تغییر در شیوهٔ اتصال آنها است.
نظریههای دالتون نارسایی ها و ایرادهایی دارد و اما آغازی مهم بود. مواردی که نظریهٔ دالتون نمیتوانست آنها را توجیه کند:
*پدیدهٔ برقکافت (الکترولیز) و نتایج مربوط به آن
*پیوند یونی – فرق یون با اتم خنثی
*پرتو کاتدی
*پرتوزایی و واکنش هسته ای
*مفهوم ظرفیت در عناصر گوناگون
*پدیدهٔ ایزوتوپی
قسمت اول نظریهٔ دالتون تأیید فیلسوف یونانی (دموکریت) بود.
نظریهٔ دالتون از سه قسمت اصلی (قانون بقای جرم – قانون نسبت های معین- قانون نسبت های چندگانه) میباشد.
مطالعهٔ اتمها و ذرات ریزتر فقط به صورت غیرمستقیم و از روی رفتار (خواص) امکانپذیر است.
اولین ذرهٔ زیراتمی شناخته شده الکترون است. مواردی که به کشف و شناخت الکترون منجر شد:
*الکتریسیته ساکن یا مالشی
*پدیدهٔ الکترولیز (برقکافت)
*پرتو کاتدی
*پدیدهٔ پرتوزایی
مدل اتمی جوزف تامسون
مدل اتمی تامسون (کیک کشمشی، مدل هندوانه ای )
*الکترون با بار منفی، درون فضای ابرگونه با بار مثبت، پراکنده شدهاند.
*اتم در مجموع خنثی است. مقدار بار مثبت با بار منفی برابر است.
*این ابر کروی مثبت، جرمی ندارد و جرم اتم به تعداد الکترون آن بستگی دارد.
*جرم زیاد اتم از وجود تعداد بسیار زیادی الکترون در آن ناشی میشود.
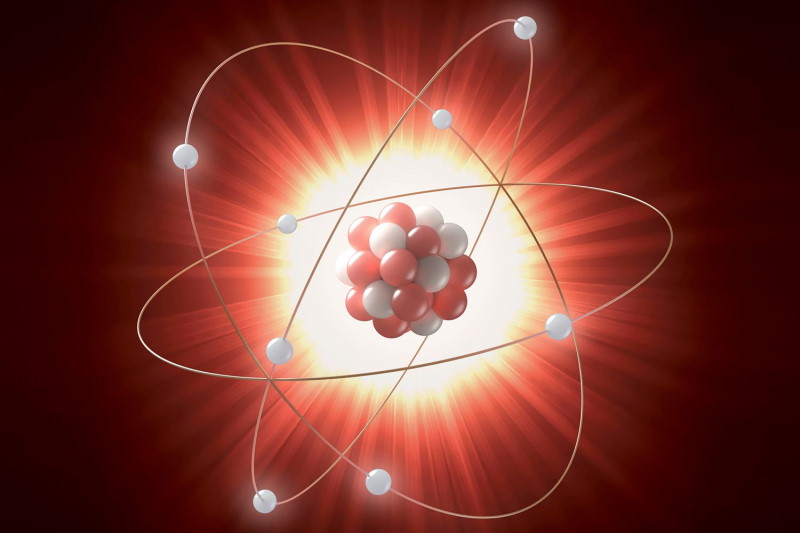
مدل اتمی ارنست رادرفورد
رادرفورد با استفاده از بمباران ورقه نازک طلا به وسیله ذرات پرانرژی آلفا، توانست به چگونگی قرار گرفتن الکترون ها و پروتون ها در اتم و همچنین وجود هسته در آن پی ببرد. این مدل به نام مدل اتمی منظومه شمسی شناخته می شود.
*هر اتم دارای یک هسته کوچک است که بیشتر جرم اتم در آن واقع است.
*هسته اتم دارای بار الکتریکی مثبت است.
*حجم هسته در مقایسه با حجم اتم بسیار کوچک است زیرا بیشتر حجم اتم را فضای خالی تشکیل میدهد.
*هسته اتم به وسیلهٔ الکترونها محاصره شدهاست.
مدل اتمی نیلز بور
او یکی از محققان موفق در این راه بود که با وجود اشتباه بودن مدل او بازهم در خیلی مکانها مانند انرژی اتمی از آن استفاده میشود.
*اتم دارای هسته کوچک اما سنگین با بار مثبت است.
*هسته در اتم در حجم کمی قرار دارد که اطراف آن الکترونها بر روی مدارهایی مانند منظومه شمسی به دور آن میچرخند.
اطلاعات جدیدی اضافه شد:
همچنین ایشان بر این باور بودند که الکترونها بر روی مدارهایی به دور هستهٔ اتم پیوسته در حال گردش اند و این نظریه علاوه بر نارسا بودن اطلاعات
سودمندی در رابطه با ساختار اتم میدهد، منظور از نارسا بودن این است که شکلهای الکترونها به صورت ناقص ترسیم شده میباشد در حالی که امروزه میدانیم
نظریه کامل تری با نام مدل لایهای عرضه شدهاست.
مدل سامرفلد
سامرفلد برای حرکت الکترون اطراف هسته علاوه بر مسیر دایره ای شکل، مسیر های بیضی شکل را نیز در نظر گرفت. این نظریه سامرفلد چندگانگی خطوط طیفی را توجیه می کند؛ زیرا سامرفلد دریافت که بین مدار های فرعی دایره ای و بیضی شکل اختلاف انرژی جزئی وجود دارد که باعث می شود به جای یک خط طیفی، چندین خطوط طیفی نزدیک به هم ظاهر شود. وی اندازه حرکت زاویه ای الکترون ها را عدد کوانتومی اوربیتالی (l) نامید که رابطه آن با عدد کوانتومی اصلی(n) به صورت زیر می باشد: …وl=۱،۲،۳
مدل اتمی شرودینگر(لایهای)
یک مدل اتمی است که امروزه پذیرفته شدهاست ولی هنوز از مدل اتمی بور برای نمایش اتم استفاده میشود(بین عوام). در این مدل مانند مدل بور هسته که عمدهٔ جرم اتم را تشکیل داده در مرکز اتم قرار دارد و الکترونها با انرژیهای مختلف به دور هسته در حال گردش هستند. با این تفاوت که در این مدل الکترونها به شکل ابری که ابر الکترونی نامیده شدهاست در اطراف هسته اتم و در فضای بسیار بزرگی که قطر آن ۱۰۰۰۰ برابر قطر هستهٔ اتم است در حرکتند.