نقطه ذوب و بررسی عوامل موثر بر آن
یکی از چیز هایی که برای شناسایی مواد شیمیایی اهمیت دارد نقطه ذوب است. نقطه ذوب هر ماده منحصر به فرد است؛ اما اینکه دو ماده بتوانند نقطه ذوب یکسانی داشته باشند هم امری طبیعی است که در ادامه به آن می پردازیم.
نقطه ذوب چیست؟
در یک تعریف کلی، نقطه ذوب، دمایی است که در آن ماده از حالت جامد به مایع تبدیل می شود.
این به عنوان یک تعریف اولیه و کلی خوب است اما کامل نیست. ما موارد متعددی داریم که ماده در آن ها تغییر شکل می دهد و دیگر جامد نیست اما مایع هم نیست. مثلا فرض کنید پلیمری داریم که در 89 درجه سانتی گراد کاملا مایه است اما در 70 درجه سانتی گراد نیز جامد نیست و یک خمیر کم چگال است.
بنابراین ما باید در تعریف نقطه ذوب بیشتر دقت کنیم و تعریف مان را کامل تر کنیم. این کامل کردن در این چند خط نمی گنجد و باید خیلی چیز ها بدانیم تا بتوانیم یک تعریف جامع ارائه کنیم. از دیدگاه ترمودینامیک، دمای ذوب، دمایی است که در آن، فاز جامد و مایع در تعادل (تعادل دمایی) باشند.
این تعریف ظاهرا کامل ترین و بهترین تعریف برای دمای ذوب است و ما باید به همین تعریف استناد کنیم؛ چرا؟ چون معادلات ترمودینامیک به خوبی می تواند آن را پیش بینی کند. ما هم به دنبال همین هستیم. هر گاه تعریفی داشته باشیم که معادلات رياضی از آن حمایت کند، آن تعریف برای ما لازم و کافی بوده و ما آن را معیار همه کار های بعدی مان قرار خواهیم داد.
بدیهی است که بالاتر از نقطه ذوب، ماده به صورت مایع و پایین تر از آن به صورت جامد خواهد بود. تنها در نقطه ذوب است که ما می توانیم، هم فاز مایع و هم فاز جامد را به صورت همزمان داشته باشیم.
پس با حالت های خمیری چه کنیم؟
این حالت ها را نه جامد و نه مایع، که حالت نیمه جامد در نظر می گیریم. حرارت دادن به ماده را ادامه می دهیم تا زمانی که اولین قطرات مایع دیده شود. از اینجا به بعد است که می توانیم بگوییم حالت مایع و جامد در تعادل هستند. بنابراین، حالت نیمه جامد را به نوعی جامد در نظر می گیریم تا مایع.
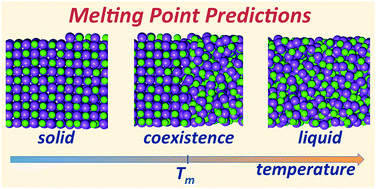
نقطه ذوب یک نقطه نیست؛ یک محدوده است.
شاید برایتان جالب باشد اگر بدانید که نقطه ذوب، عملا یک نقطه نیست؛ بلکه یک محدوده است.
در مورد بسیاری از مواد شیمیایی، ما نمی توانیم یک نقطه خاص را به عنوان نقطه ذوب معرفی کنیم. در مورد این مواد، ما یک محدوده را به عنوان نقطه ذوب در نظر می گیریم. در این مواد، ما یک نقطه آغازین داریم که در آن، اولین قطره مایع مشاهده می شود. سپس حرارت دهی را ادامه می دهیم تا به جایی که آخرین ذره جامد هم به مایع تبدیل شود و آن را نقطه پایانی در نظر می گیریم.
این دمای پایانی و آغازین در مورد همه مواد وجود دارد؛ اما در بعضی مواد گسترده تر و در بعضی مواد فشرده تر است و ما آن را به صورت نقطه می بینیم؛ در بسیاری از مواد نمی توانیم با این قاطعیت از یک نقطه خاص صحبت کنیم.
عوامل موثر بر نقطه ذوب
این عوامل را می توانیم به دو دسته عوامل مولکولی و عوامل محیطی تقسیم کنیم.
عوامل محیطی: این عوامل از طرف محیط بر ماده اعمال می شود و می تواند بر نقطه ذوب آن اثر گذار باشد.
1_ وجود ناخالصی
وجود ناخالصی های درون ماده می تواند به شدت بر نقطه ذوب ماده اثر گذار باشد. این ناخالصی ها می تواند به صورت همگن و یا ناهمگن در ماده جامد پخش شده باشد. هر یک از این ها اثر متفاوتی بر نقطه ذوب می گذارد.
2_ فشار
یکی از عواملی که به صورت جزئی بر نقطه ذوب اثر می گذارد فشار است. فشار محیط می تواند به میزان کمی نقطه ذوب را تغییر دهد. این تغییر می تواند در جهت افزایش یا کاهش نقطه ذوب اثر کند.
در موادی که فاز مایع آن ها چگال تر از جامد آن باشد، افزایش فشار باعث کاهش نقطه ذوب و در مواردی که فاز جامد آن چگال تر از مایع آن باشد، افزایش فشار باعث افزایش نقطه ذوب خواهد شد.
عوامل مولکولی: عواملی هستند که در ساختار خود مولکول های جامد باعث ایجاد تاثیر بر نقطه ذوب می شوند.
1_ ایزومری و شکل فضایی مولکول
یکی از مهمترین موارد موثر بر نقطه ذوب یک ماده مشخص، وجود ایزومری است. این مورد بیشتر در مورد مواد آلی مطرح می شود. وجود ایزومر هایی که بتواند برهمکنش مولکول ها در کنار یکدیگر را بهبود بخشد باعث افزایش نقطه ذوب و عواملی که مقدار این برهمکنش ها را کاهش دهد باعث کاهش نقطه ذوب می شود.
به عنوان مثال می توانیم به ایزومر های پروپیل الکل اشاره کنیم. دو ایزومر برای این مولکول وجود دارد. یکی به صورت ایزومر نرمال و دیگری که آن را با نام ایزو پروپیل الکل نیز می شناسیم. تفاوت این دو مولکول در محل قرار گیری گروه هیدروکسیل است. در مولکول پروپیل الکل، گروه هیدروکسیل به کربن انتهای زنجیره و در ایززوپروپیل الکل، گروه هیدروکسیل به کربن میانی متصل است.
با این تفاوت بسیار اندک یک تفاوت بسیار بزرگ در نقطه ذوب مشاهده می شود. نقطه ذوب ایزوپروپیل الکل برابر با 89- درجه سانتی گراد است در حالی که نقطه ذوب پروپیل الکل برابر با 126- می باشد. علت این تفاوت در چیست؟
این تفاوت بخاطر نحوه قرار گیری مولکول ها در شبکه جامد است. مولکول پروپیل الکل و ایزو پروپیل الکل، تقریبا آمفوتر به حساب می آیند و بنابراین، در یک تجمع سازمان یافته، مولکول های ایزو پروپیل الکل به صورت بغل به بغل و مولکول های پروپیل الکل از سر یا از دم و به صورت تجمهات کروی شکل شبکه جامد شان را می سازند.
بنابراین در توده حاوی پروپیل الکل برهمکنش ها کمتر و بنابراین شکل گیری شبکه جامد هم سخت تر خواهد بود. بنابراین در دمای پایین تری به صورت جامد در می آید.
2_قطبیت و بحث ممان دو قطبی
همه ما می دانیم که مولکول های قطبی به صورت طبیعی به یکدیگر نیرو های دافعه و جاذبه وارد می کنند. این که نیروی بینابین آن ها از نوع جاذبه و یا دافعه باشد، کاملا به نحوه قرار گیری آن ها در کنار هم مربوط است. اما در بسیاری از موارد ما با یک مولکول قطبی سر و کار نداریم؛ بلکه مولکولی داریم که صرفا یک ممان دو قطبی ضعیف تا نسبتا قوی نشان می دهد.
در این صورت، مولکولی که بتواند ممان دو قطبی بزرگتری ایجاد کند، دمای ذوب بالاتری را نشان خواهد داد. به عنوان یک مثال بسیار جالب، ایزومر های مختلف زایلین را برررسی می کنیم.
زایلین سه ایزومر به صورت اورتو و متا و پارا دارد. که در تصویر زیر مشاهده می کنید.
اورتو زایلین در 25-، متا زایلین در 48- و پارا زایلین در 13 درجه سانتی گراد ذوب می شوند. همانطور که کاملا واضح است، اثر وجود یک ممان دو طبی ضعیف را می توان به خوبی مشاهده کرد. البته این تفاوت را همچنین می توان به شکل فضایی مولکول ها و نحوه قرار گیری آن ها در شبکه بلور نیز نسبت داد.