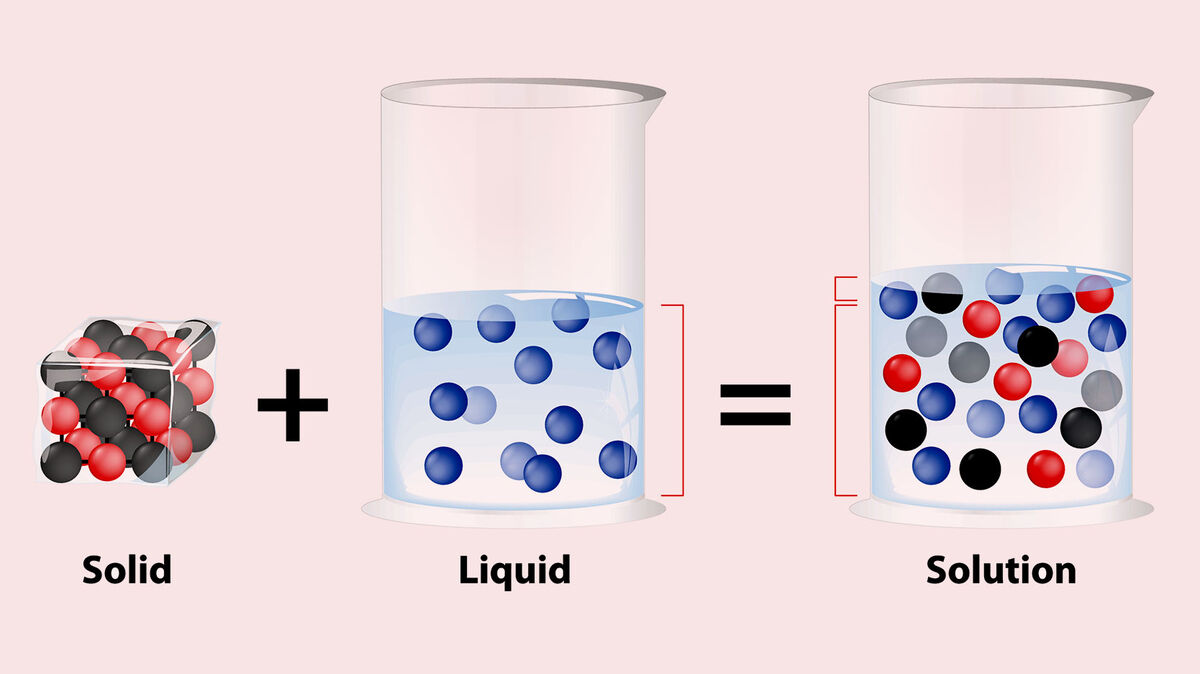
برای درک اثر یون مشترک ابتدا باید به انحلال نمک ها نگاهی بینداریم و با آن آشنا شویم.
یک نمک معدنی چگونه در حلال حل می شود؟
برای انحلال یک نمک معدنی در حلالی مثل آب، باید چند مرحله به شرح زیر طی شود:
1_فروپاشی شبکه بلور
در این مرحله، نظم شبکه بلورین از بین رفته و یون هایی که در یک شبکه منظم در کنار هم نشسته بودند؛ یکدیگر را رها کرده و به صورت زوج یون (یون منفی و مثبت در یک فاصله بسیار کوتاه از هم) در می آیند.
2_ آب پوشی زوج یون ها
در این مرحله، زوج یون های رها شده در حلال توسط مولکول های آن، حلال پوشی می شوند. حلال پوشی می شوند؛ یعنی این که یک لایه از مولکول های حلال، به دور زوج یون پیچیده و آن ها را در بر می گیرد.
3_ یون ها به صورت جداگانه در آمده و حلال پوشی می شوند
حلال پوشی زوج یون ها باعث ایجاد یک دو قطبی مثبت و منفی شده و به تدریج حلال پوشی زوج یون را به حلال پوشی تک یون ها می رساند. یعنی این که با گذشت زمان، زوج یون از هم فاصله بیشتری گرفته و هر یک از آن ها توسط مولکول های حلال به صورت جداگانه، حلال پوشی می شود.
در این حالت، هر یون توسط یک حباب از مولکول های حلال احاطه شده و در فاصله کوتاهی از حباب زوج یون خودش حرکت می کند. در این حالت، درست است که فاصله زوج یون ها کم نیست؛ اما آن قدر هم زیاد نیست که بتوان گفت یون ها به صورت تکی و آزادانه حرکت دارند.
اثر یون مشترک وارد می شود
تا به اینجا متوجه شدیم که اصلا یک نمک معدنی چگونه در آب یا هر حلال دیگری حل می شود. حال باید با یک سری محدودیت ها نیز آشنا شوید. یکی از این محدودیت ها حد اشباع محلول است. همانطور که می دانید؛ هر نمک نمی تواند به هر مقدار در یک حلال حل شود. به عبارت دیگر ما نمی توانیم هر مقدار که دلمان بخواهد نمک در آب حل کنیم.
هر نمک به مقدار مشخصی در آب حل شده و یک محلول اشباع می سازد. پس از آن، هر چه نمک اضافه کنیم دیگر حل نشده و از محلول پس زده می شود. این محدودیت از ویژگی های ذاتی هر حلال و حل شونده ای است و البته می تواند توسط عوامل محیطی مثل دما و اثر یون مشترک و… نیز تحت تاثیر قرار بگیرد.
همه مطالبی که گفته شد درباره انحلال یک نوع نمک خاص صادق است. مثلا من بخواهم نمک سدیم کلرید را در آب حل کنم. در این صورت همه حرف های بالا در مورد آن صادق خواهد بود. حالا اگر بخواهم نمک دیگری را نیز در آب حل کنم چه اتفاقاتی رخ می دهد؟ مثلا فرض کنید که نمک پتاسیم کلرید و سدیم کلرید را با هم در آب حل کنیم. اول این که آیا حل شدن یکی از آن ها بر روی دیگری اثر می گذارد یا نه؟ و دوم این که اگر اثر دارد این اثر به چه شکلی خودش را نشان می دهد؟
اثر یون مشترک کجا دیده می شود؟ کجا دیده نمی شود؟
هنگامی که دو نمک دارای یون مشابه در یک حلال معین حل شود؛ اثر یون مشترک مشاهده می شود. مثلا اگر بخواهیم نمک پتاسیم کلرید و سدیم کلرید را در آب حل کنیم؛ اثر یون مشترک خودش را نشان خواهد داد. اما در مورد انحلال دو نمک پتاسیم کلرید و سدیم سولفات، اثر یون مشترک دیده نمی شود. چون هیچ یونی (کاتیون یا آنیون) بین این دو نمک مشترک یا مشابه نیست.
اما در مورد دو نمک سدیم کلرید و سدیم سولفات این طور نیست. یون سدیم در این دو نمک مشابه بوده و می تواند اثر یون مشترک را ایجاد کند. بنابراین یون مشترک هم می تواند در مورد کاتیون و هم در مورد آنیون مشاهده شود. نکته دیگر این که اثر یون مشترک فقط هنگامی دیده می شود که دو نمک در حلال مورد نظر انحلال پذیر باشند.
مثلا در مورد دو نمک کلسیم کلرید و کلسیم هیدروکسید اثر یون مشترک مشاهده نمی شود. در این مورد، نمک کلسیم کلرید محلول و کلسیم هیدوکسید نامحلول است. بنابراین اثر یون مشترک در مورد یون کلسیم نمی تواند مشاهده شود.
اثر یون مشترک چیست؟
در یک کلام و به صورت کاملا کلی و بدون جزئیات، اثر یون مشترک یعنی تاثیر گذاری غلظت یک نمک بر انحلال پذیری نمک حاوی یون مشترک با آن. این اثر اما چگونه مشاهده می شود و تاثیر گذاری می کند؟
هنگامی که یک نمک مثل سدیم کلرید در آب حل شود؛ غلظت معینی از یون های سدیم و کلر در آب ایجاد می شود که طبیعتا متناسب با مقدار نمکی است که در آب حل کرده ایم. در این زمان، یک غلظت مشخص از یون ها وجود دارد و اگر از یک حد مشخص (اشباع) عبور کند؛ از آب پس زده می شود.
با ورود نمک دیگر که حاوی یون مشترک است؛ غلظت یون مشترک زیاد شده و بر روی انحلال پذیری هر دو نمک اثر می گذارد. به عنوان مثال، هنگامی که نمک سدیم کلرید در آب حل می شود؛ غلظت یون های سدیم در آب زیاد می شود. حال اگر بخواهیم نمک سدیم سولفات را نیز در آن حل کنیم؛ غلظت یون های سدیم (که یون مشترک است) خیلی زیاد می شود.
از آنجایی که یک حد مشخص برای انحلال یون های سدیم در آب وجود دارد (حد اشباع). بنابراین نمی توان به هر مقدار دلخواهی سدیم در آب وارد کرد و انتظار داشت که انحلال رخ دهد. پس این بار (پس از افزایش نمک دوم به محلول آب و نمک اول)، مقدار کمتری از نمک اول حل خواهد شد. همچنین مقدار کمتری (نسبت به حالتی که فقط همین نمک در آب حل شود) انحلال خواهیم داشت.
به این اثر که در نتیجه آن، غلظت یک نمک روی انحلال پذیری نمک دیگری که حاوی یون مشترک است اثر می گذارد؛ اثر یون مشترک گفته می شود.
به این پست چند تا ستاره میدی؟
برای امتیاز دهی روی ستاره ها کلیک کن
امتیاز میانگین 5 / 5. تعداد رای ها 1