پیوند شیمیایی چیست؟ وقتی می گوییم که هیدروژن با یک پیوند یگانه به کربن متصل است منظورمان چیست؟ چه چیزی باعث شده تا این دو اتم بتوانند در کنار هم قرار گرفته و یک مولکول را بسازند؟ انواع پیوند های شیمیایی از دیدگاه شیمی فیزیک و اوربیتال مولکول کدامند؟ و…
پیش از پرداختن به این که انواع پیوند های شیمیایی از دیدگاه نظریه اوربیتال مولکولی چه هستند؟ ابتدا باید به بنیاین های نظریه اوربیتال مولکولی نگاهی بیندازیم. البته قصد ما بررسی یا تشریح نظریه اوربیتال مولکولی نیست و فقط بخش کوچکی را کار داریم که به آن می پردازیم.
گفتار هایی از نظریه اوربیتال ملکولی
بر اساس این نظریه، هنگامی که دو اوربیتال اتمی در مجاورت هم قرار می گیرند و با هم وارد تعامل می شوند دو حالت ممکن است. اگر همپوشانی آن ها در جهتی باشد که لوب های هم نامی از اوربیتال های اتمی شان با هم همپوشانی کرده باشد؛ همپوشانی مثبت بوده و منجر به ایجاد اوربیتال مولکولی پیوندی شده و منجر به ایجاد پیوند می شود.
اما اگر همپوشانی شان در جهتی باشد که لوب های نا هم نام آن ها به هم برسد؛ منجر به ایجاد یک اوربیتال مولکولی ضد پیوندی شده و هیچ پیوندی ایجاد نمی شود. بلکه اوربیتال مولکولی می سازد که ضد پیوندی است. در این حالت یک صفحه گرهی ساخته می شود. برای درک بهتر به تصویر زیر توجه کنید.
انواع پیوند شیمیایی
برای معرفی انواع پیوند های شیمیایی نیاز است تا ابتدا درباره همپوشانی اوربیتال ها صحبت کنیم. البته پیش فرض ما این است که شما با اوربیتال های اتمی آشنایی دارید. بنابراین از ذکر آن خودداری می کنیم. اما همپوشانی اوربیتال های اتمی چیست و چگونه رخ می دهد؟
همانطور که می دانید؛ برای هر اوربیتال اتمی یک معادله موج وجود دارد که می توان رفتار الکترون در آن اوربیتال را از آن استخراج کرد. همچنین می دانید که هر اوربیتال اتمی غیر از اوربیتال های s دارای دو لوب با علامت های مخالف هم است. مثلا اوربیتال p دارای دو لوب است که یکی منفی و دیگری مثبت است یا مثلا اوربیتال های d دارای چهار لوب است که دو تای آن منفی و دو تا مثبت است.
البته باید به این نکته توجه کنید که این مثبت و منفی چیزی است که ما به اوربیتال ها نسبت می دهیم و اساسا این منفی و مثبت بودن به لحاظ فیزیکی ماهیت نداشته و صرفا نشان دهنده علامت تابع موج است. یعنی این که مثبت و منفی که از آن صحبت می کنیم جنبه ریاضیاتی و محاسباتی داشته و به این نحو نیست که لوب های مثبت و منفی فرقی داشته باشند.
همه این ها یکسان هستند و صرفا علامت آن ها فرق دارد. مثلا می توانید فرض کنید که ما درباره عدد 1 صحبت می کنیم. حالا به من بگویید که 1- و 1+ چه فرقی دارند؟ طبیعتا 1 همان 1 است و ارزش آن به اندازه یک واحد است و فقط علامت آن فرق دارد. 1+ یعنی یک واحد از آن چیز وجود دارد و 1- یعنی یک واحد از آن چیز کم است.
امیدوارم این منفی و مثبت بودن را درک کرده باشید. این مثبت و منفی در ظاهر اهمیت خاصی ندارد؛ چون 1 همان 1 است؛ اما در همپوشانی اوربیتال های اتمی مهم ترین نقش را همین + یا – بازی می کند.
همپوشانی اوربیتالی چیست؟
همپوشانی اوربیتالی از جنس یک تعامل بین دو موج است. همانطور که می دانید؛ ما در تفسیر ماهیت اوربیتال ها تاکید داریم که آن ها از جنس توابع موج هستند. شما از دبیرستان با همپوشانی موج های مکانیکی (همپوشانی موج ها در یک طناب) آشنایی دارید و بار ها با آن برخورد کرده اید.
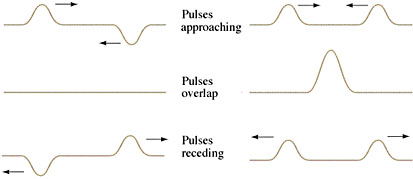
می دانید که همپوشانی بین دو موج یا از نوع سازنده است و یا از نوع مخرب. در همپوشانی سازنده، دو موج ترکیب شده و موجی قوی تر می سازند و در همپوشانی مخرب دو موج با هم ترکیب شده و یکدیگر را تخریب می کنند. البته توجه دارید که این تخریب و یا سازش به صورت مقطعی بوده و دو موج پس از عبور از هم دوباره به حالت اولشان برمی گردند.
برای درک بهتر به تصویر زیر توجه کنید. در این تصویر، سمت چپ همپوشانی مخرب و سمت راست همپوشانی سازنده آورده شده است. تصویر بالا قبل از برخورد، تصویر وسط هنگام همپوشانی و تصویر سوم پس از برخورد است.
در مورد اوربیتال های اتمی نیز دقیقا چنینی موضوعی واقعیت دارد. اما خب طبیعتا تفاوت هایی بین آن ها با که در دنیای کوانتومی کار می کنند با موج طناب که در دنیای مکانیک کلاسیک اتفاق می افتد تفاوت های فاحشی وجود دارد اما بنیاد ها تقرییبا یکسان و یا مشباه است و نباید به آن ها پرداخت.
صرفا کافی است بدانید که ما دو نوع برهمکنش بین اوربیتال های اتمی داریم که همان سازنده و مخرب هستند. ما در اینجا آن ها را به صورت همپوشانی پیوندی (همان همپوشانی سازنده) و همپوشانی ضد پیوندی (همان همپوشانی مخرب) می شناسیم.
پیوند شیمیایی از نوع سیگما (σ)
یکی از انواع همپوشانی در اوربیتال های اتمی به صورت همپوشانی است که منجر به ایجاد پیوند سیگما می شود. در این نوع همپوشانی، اوربیتال های اتمی از سر به هم می رسند و اصطلاحا به آن همپوشانی سر به سر هم گفته می شود.
این نوع همپوشانی می تواند بین اوربیتال های s با s یا p با p و یا حتی d با d و یا ترکیبی از این ها یعنی s با p و یا s با d و یا p با d رخ دهد. در هر صورت، شاخصه اصلی این نوع همپوشانی، سر به سر بودن آن است. برای درک بهتر به انواع پیوند سیگما در تصویر زیر توجه کنید.
نکته: پیوند های سیگما همچنین می تواند بین اوربیتال های هیبریدی نیز برقرار شده و صرفا مخصوص اوربیتال های ساده نیست. چنان که در تصویر بالا هم مشاهده می کنید؛ مثلا اوربیتال های حاصل از هیبریداسیون مثل اوربیتال sp نیز می توانند این نوع پیوند را ایجاد کنند.
در نهایت در اثر همپوشانی این اوربیتال ها و ایجاد پیوند سیگما، یک اوربیتال مولکولی لوله ای شکل (بشتر شبیه یک کالباس کامل است) ایجاد می شود. برای درک بهتر به تصویر زیر توجه کنید.
پیوند شیمیایی از نوع پای (π)
این نوع پیوند از همپوشانی بغل به بغل (پهلو به پهلو) اوربیتال های p ایجاد می شود. بنابراین هرگز توسط اوربیتال های s ایجاد نمی شود. هر پیوند پای یک پیوند دوگانه به حساب می آید و طبیعتا قدرت آن از پیوند سیگما که پیوندی یگانه است بیشتر خواهد بود.
در اثر برهمکنش بین اوربیتال های p در مجاورت هم، دو نوع برهمکنش یا همان همپوشانی ممکن است. اگر همپوشانی مثبت باشد منجر به شکل گیری اوربیتال مولکولی پای شده و یک پیوند دوگانه ایجاد می شود و اگر همپوشانی منفی باشد؛ منجر به ایجاد یک اوربیتال مولکولی ضد پیوندی خواهد شد. برای درک این نوع پیوند به تصویر زیر توجه کنید.
پیوند شیمیایی از نوع دلتا (δ)
این نوع پیوند فقط و فقط در مورد اوربیتال های d رخ داده و در سایر اوربیتال ها مشاهده نمی شود (چون امکان نداردD:). در این نوع پیوند؛ دو اوربیتال d به صورت مقابل به مقابل (برخورد رو به رو) با هم برهمکنش یا همان همپوشانی کرده و پیوند دلتا را ایجاد می کنند.
پیوند دلتا نسبت به پیوند سیگما و پای ضعیف تر بوده و از اهمیت کمتری برخوردار است. برای درک نحوه همپوشانی اوربیتال های d برای ایجاد این نوع پیوند توجه کنید.
توجه: اوربیتال های d اگر به صورت پهلو به پهلو به هم برسند می توانند پیوند های سیگما ایجاد کنند اما در صورتی که از رو به رو با هم تعامل کنند پیوند دلتا ایجاد می کنند. لطفا به تفاوت تصویر بالا با تصویر هایی که در مورد پیوند سیگما داده شد توجه کنید. این ها کاملا فرق دارند.











4 دیدگاه در “بررسی و تشریح کامل انواع پیوند شیمیایی (سیگما، پای و دلتا)”
ممنون از توضیحات مفید و قابل فهم
خیلی ممنون از توضیحاتتون
توضیحات عالی بود
توضیحات روان و قابل فهم بود یک دنیا ممنونم