پیش از هر چیزی ابتدا باید با ساختار مایسل ها آشنا شویم و سپس به بررسی نحوه شکل گیری هر یک از آن ها بپردازیم.
مایسل چیست؟
در یک تعریف بسیار ساده و ابتدایی، مایسل، تجمعی سازمان یافته از مولکول های آمفوتر است.
مولکول آمفوتر چیست؟ یک مولکول آمفوتر از دو بخش که یکی آبدوست و دیگری آبگریز است ساخته شده. به عنوان مثال SDS یا همان سدیم دودسیل سولفات یکی از این مولکول هاست. در تصویر زیر ساختار شیمیایی این مولکول را مشاهده می کنید.
در نماد گذاری های مرسوم، معمولا هر مولکول آمفوتر را با یک سر و یک دم متصل به آن نشان می دهیم. سر، نماد بخش آبدوست و دم نماد قسمت آبگریز است.
در اینجا یک سوال بسیار مهم ظهور می کند؛ وقتی یک مولکول آمفوتر وارد محیط آلی یا معدنی شود، چه اتفاقی می افتد؟ اگر مولکول آلی بود، طبیعتا در محیط آلی حل شده و در محیط معدنی از آن جدا می شده و به صورت یک فاز جداگانه در می آمد؛ مثل اتفاقی که برای مخلوط آب و روغن اتفاق می افتد.
اما در مورد یک مولکول آمفوتر چطور؟
پیش از پاسخگویی به این سوال، باید بدانید که هر ماده ای در هر ماده دیگری انحلال پذیر است. شاید در نگاه اول، این جمله ای غلط به نظر برسد، اما این یک واقعیت علمی است.
هر ماده ای در هر ماده دیگری قابل انحلال است؛ اما مقدار این انحلال در موارد مختلف متفاوت است. به عنوان مثال، انحلال پذیری هگزان () در یک حلال آلی دیگر مثل دی اتیل اتر (
) بسیار زیاد است؛ به طوری که این دو به طور کامل در هم حل می شوند.
اما همین هگزان، در آب اصلا حل نمی شود. اما این اصلا کلمه علمی نیست. باید بدانید که پس از ورود هگزان در آب، حقیقتا مقداری از هگزان در آب پخش می شود. اما این مقدار به حدی کم است که قابل چشم پوشی است. یعنی نمی توانیم با ابزار های کلاسیک اندازه گیری وجود آن را نشان دهیم. اما اگر از آن طیف سنجی کنیم، وجود هگزان در آب را نشان می دهد.
خب حالا این دانسته به چه کار می آید؟
باید عرض کنم که همین اتفاق در مورد مولکول های آمفوتر نیز رخ می دهد و وقتی که یک مولکول آمفوتر وارد محیط آلی یا معدنی می شود، در آن محیط پخش شده و به مقدار مشخصی (در مورد هر مولکولی متفاوت است) در آن محیط حل می شود.
اما یک تفاوت اساسی بین مولکول های آمفوتر و مولکول های غیر آمفوتری مثل هگزان وجود دارد. آن تفاوت در غلظت های زیاد تر آشکار می شود. فرض کنید که بخواهیم 1 میلی لیتر هگزان را در 10 میلی لیتر حل کنیم. قاعدتا چنین اتفاقی نمی افتد و صرفا مثدار بسیار بسیار بسیار کمی از آن حل شده و بقیه آن به صورت یک فاز جدا در بالای آب تجمع می کند.
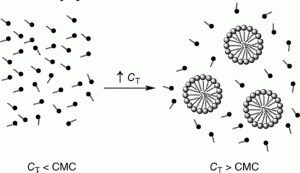
اما این اتفاق در مورد یک مولکول آمفوتر رخ نمی دهد. با افزایش غلظت یک مولکول آمفوتر در محیط حلال، ابتدا مثل همه مولکول های دیگر، پراکندگی و انحلال جزئی رخ می هد. اما با افزایش مقدار ماده، اتفاق جدیدی زخ می هد.
اگر غلظت مولکول آمفوتر از میزان مشخصی بیشتر شود؛ به تدریج این مولکول ها در کنار یکدیگر تجمع کرده و ساختار های سازمان یافته ای به صورت مایسل و یا مایسل معکوس را ایجاد می کنند. البته کار به همین جا ختم نشده و با افزایش غلظت، این مایسل ها می توانند ساختار های جدیدی را ایجاد کنند که استفاده های فراوانی در سنتز نانو ذرات دارد و سلف اسمبلی (self assembly) یا همان فرآیند خود سرهم شدن، اساسا از اینجا متولد می شود و بعدا در سایر زمینه های سنتزی توسعه می یابد.
مراحل شکل گیری مایسل
در مرحله اول و پس از افزودن مقدار بسیار کم آمفوتر، مولکول ها در محیط حلال پراکنده می شوند. در این حالت، فاصله بین مولکول ها بسیار زیاد بوده و عملا هیچ برهمکنشی بین آن ها تعریف نمی شود.
در مرحله بعدی و با افزایش غلظت مولکول های آمفوتر، اولین تجمعات، در اثر برهمکنش های واندر والسی بین بخش های مختلف مولکول های آمفوتر شکل می گیرد و اولین هسته های شکل گیری مایسل ها ایجاد می شود.
در مرحله بعدی و با زیاد شدن غلظت مولکول های آمفوتر در محیط حلال، سرانجام این تجمعات سازمان یافته تر شده و کره هایی ایجاد می شود که در این کره ها، یا سر های آبدوست مولکول آمفوتر به سمت مرکز کره و یا به سرمت بیرون از آن جهت گیری کرده اند.
در صورتی که سر های مولکول آمفوتر به سمت خارج و دم های آبگریز آن ها به سمت داخل باشد؛ ساختار حاصل را مایسل و در صورتی که سر های آبدوست به سمت داخل و دم های آبگریز به سمت خارج از کره جهت گیری کرده باشند؛ ساختار حاصل را مایسل معکوس می گویند.
در تصویر زیر، شکل دو مایسل که یکی مایسل معمولی و دیگری مایسل معکوس است را مشاهده می کنید.
در ظاهر این بسیار ساده رخ داده است؛ اما در باطن قضیه به این سادگی نیست. ما نمی توانیم در هر شرایطی، صرفا با افزایش غلظت مولکول های آمفوتر، مایسل ها را داشته باشیم.
نقطه CMC چیست؟
همانطور که در بالا گفته شد؛ باید یک حداقل غلظتی از مولکول های آمفوتر وجود داشته باشد تا در نتیجه آن مایسل های شکل گیری کنند. این حداقلی از غلظت مولکول آمفوتر (سورفکتانت) که باید وجود داشته باشد تا مایسل ها شروع به شکل گیری کنند را به عنوان نقطه بحرانی شکل گیری مایسل یا به عبارت دیگر نقطه CMC یا همان critical micelle consentration می گویند.
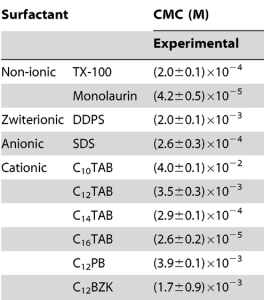
این نقطه برای هر سورفکتانت (مولکول آمفوتر) متفاوت بوده و ویژه خود آن مولکول است. در جدول زیرف نقطه CMC برخی از سورفکتانت ها بر حسب مولاریته آورده شده است؛ به آن توجه کنید.
نقطه کرافت چیست؟
اصلی ترین شرط شکل گیری مایسل غلظت است؛ اما یکی دیگر از شرایط مهم و اساسی دما است. به نحوی که اگر غلظت سورفکتانت (مولکول آمفوتر) بسیار زیاد باشد؛ اما دما در محدوده خاص شکل گیری مایسل نباشد؛ اساسا هیچ مایسیل ایجاد نشده و تجمع مولکول ها به نحوی است که یک جامد هیدراته را ایجاد می کند.
دمایی که از آن دما به بالا، شکل گیری مایسل ها شروع می شود، نقطه کرافت (krafft point) نامیده می شود. نقطه کرافت نیز همانند نقطه CMC برای هر سورفکتانتی منحصر به فرد بوده و از ویژگی های خاص آن مولکول به شمار می آید.
برای جمع بندی مطالب گفته شده به تصویر زیر توجه کنید.
نقطه کرافت، جایی روی محور دما و نقطه CMC جایی روی محور غلظت است.
مایسل معکوس چیست و چگونه ایجاد می شود؟
شکل گیری مایسل معمولی و مایسل معکوس به یک نحو است. تنها تفاوت در محیطی است که مایسل در آن ایجاد می شود. اگر مایسل در محیط آبی ایجاد شود به آن مایسل معمولی و اگر در محیط آلی ایجاد شود؛ به آن مایسل معکوس می گویند.
تفاوت مایسل معکوس و مایسل معمولی را در بالا نشان داده ایم بنابراین هرگز نباید تصور شود که ساختار مایسل و مایسل معکوس یکسان است.
در مقالات دیگر به جامد هیدراته و تجمعاتی که خود این مایسل ها شکل می دهند می پردازیم و درباره خودآرایی یا همان سلف اسمبلی (self assembly) بیشتر صحبت خواهیم کرد.