[vc_row][vc_column][vc_column_text]
بعد از شیمی ترکیبات کربن لازم است نگاهی به اتم کربن داشته باشیم.
کربن از کلمه لاتین “کربو” به معنای ذغال گرفته شده است.
آنتوان لاووازیه (Antoine-Laurent de Lavoisier) در سال 1789 از کربن به عنوان یک عنصر نام برد.

از لحاظ فراوانی جرمی پس از هیدروژن، هلیوم واکسیژن، کربن چهارمین عنصر فراوان در سراسر کیهان است.
کربن در خورشید، سایر ستارگان، دنباله دارها و جو اغلب سیارات به وفور یافت می شود.
بیشتر بدن شما از 4 عنصر اکسیژن، هیدروژن،نیتروژن و کربن تشکیل شده است که 5.18 درصد آن متعلق به کربن است.
کربن یک عنصر شیمیایی نافلز با نماد C است که در جایگاه ششم جدول تناوبی قرار دارد و دارای 6 پروتون، 6نوترون و شش الکترون است. کربن در تناوب دوم و در رأس گروه 14، جایی میان فلز فعال لیتیوم در سمت چپ جدول و نافلز بسیار فعال فلوئور در سمت راست جدول قرار گرفته است.
کربن در اثر بیگ بنگ حاصل نشده است چون این عنصر برای تولید نیاز به یک برخورد سه مرحله ای ذرات آلفا (هسته اتم هلیوم) دارد. جهان در ابتدا گسترش یافت و چنان سرد شد که امکان تولید کربن در آن غیر ممکن بود. بهرحال کربن درون ستارگانی که در آن هسته ی هلیوم با فرآیند سه گانه آلفا به کربن تبدیل می شوند، تولید شد.
کربن از طریق به اشتراک گذاشتن چهار الکترون ظرفیتی اش، با خود یا اتم عنصر های دیگر، پیوند کووالانسی تشکیل می دهد. پیوند هایی که طی آن کربن به آرایش هشت تایی دست یابد. همچنین اتم کربن نمی تواند با تشکیل پیوند یونی به آرایش پایدار گازهای نجیب برسد به عبارت دیگر یون های C+4 و C-4 ناپایدار بوده و تشکیل نمی شوند. {علت را می توان چنین تحلیل نمود که بار مؤثر هسته ی اتم کربن به اندازه ای است که به چهار الکترون ظرفیتی خود اجازه خروج نمی دهد و از تشکیل یون C+4 ممانعت به عمل می آورد و همچنین این بار مؤثر آن قدر هم نیست که بتواند چهار الکترون جذب کند و با تشکیل یون C-4 از آنها نگهداری کند.}
برخی از خصوصیات کربن:
. نقطه ذوب = 3730 c⁰
. شعاع کووالانسی = 77 pm
. شعاع واندروالسی = 170 pm
. عدد اکسایش = -4 ، -3 ، -2 ، -1 ، 0 ، +1 ، +2 ، +3 ، +4
. اولین انرژی یونش = 1090 kj/mol
. الکترونگاتیوی پائولینگ = 2.55
. الکترونخواهی = 122 (Ea /(kj mol-1
کربن دارای 15 ایزوتوپ شناخته شده از از 8C تا 22C است که از این میان دو ایزوتوپ 12C و 13C به طور طبیعی در طبیعت یافت می شوند. 14C ایزوتوپ پرتوزای طبیعی این عنصر است که دارای نیمه عمر 5730 سال است که برای تاریخ یابی رادیو کربن چوب، نقاط باستان شناسی ونمونه ها کاربرد بسیاری دارد.
11C همچنین ایزوتوپ رادیواکتیو کربن است که به 11B تجزیه می شود. این تجزیه عمدتاً به دلیل انتشار پوزیترون اتفاق می افتد و نیمه عمر آن 20.364 دقیقه است.
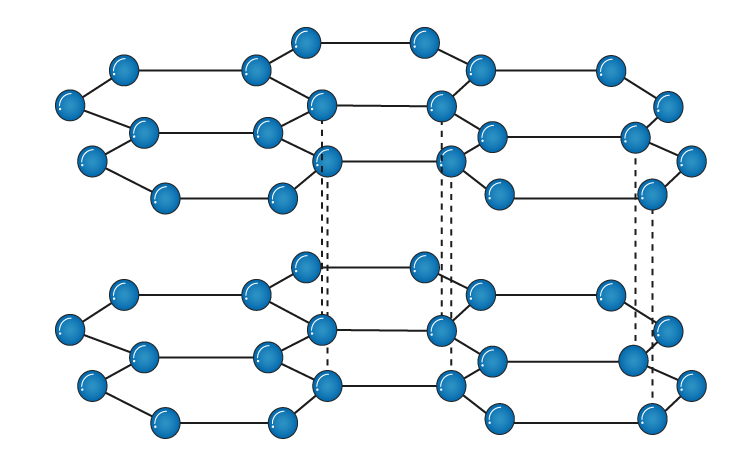
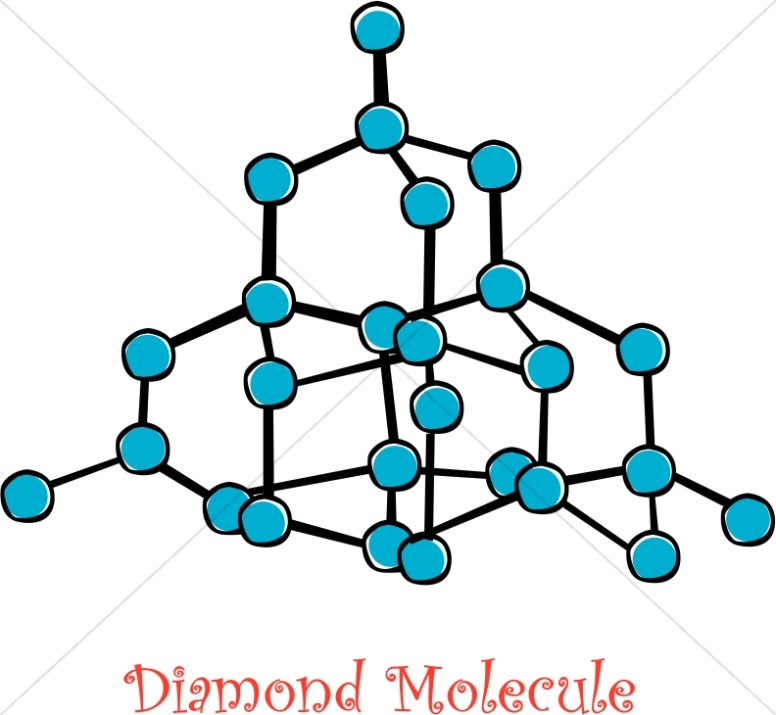
کربن همچنین دارای دگرشکل ها (آلوتروپ) های فراوان است که جالب ترین و شناخته شده ترین آن الماس و گرافیت است که از معدن استخراج می شوند. الماس و گرافیت هردو از اتصال شمار بسیار زیادی از اتم های کربن به وجود آمده اند. با این حال به شکل بارزی با یکدیگر متفاوت اند. الماس یک نارسانی الکتریکی است؛ گرافیت رسانای الکتریکی خوبی است. الماس سخت ترین ماده طبیعی شناخته شده است و بنابراین بهترین ماده برای سایش به شمار می آید؛ گرافیت لغزنده است و به عنوان نرم کننده کاربرد بسیاری دارد. گرافیت نارسانای گرما و الماس رسانای گرما است.
اما منشاء این تفاوت های گسترده در چیست؟!
در الماس هر اتم کربن پیوندهای یگانه ای به طول 154 نانومتر با چهار اتم کربن در گوشه های یک چهاروجهی منتظم تشکیل می دهد؛ که درنتیجه شبکه ی سه بعدی کووالانسی سختی به دست می دهد. الماس بالاترین رسانایی گرمایی را دارد چراکه این ساختار حرکت های گرمایی را در سه بعد به خوبی پخش می کند، {از اندازه گیری رسانایی گرمایی برای تشخیص الماس بدلی استفاده میکنند} . گرافیت از لایه های مسطح طبقه ای تشکیل شده که در آنها هر اتم کربن با سه اتم کربن دیگر به فاصله ی 142 نانومتر پیوند دارد.
-
شکل مولکولی گرافیت -
شکل مولکولی الماس
الماس در حدود 160 کیلومتری زیر پوسته ی زمین درون صخره های مذاب گوشته تشکیل می شود، در این بخش از زمین فشار و حرارت به قدری است که فرایند تبدیل کردن کربن به الماس می تواند صورت پذیرد. از حداقل شرایط این فرایند میتوان به دمای 400 درجه سانتی گراد و فشار 30هزار اتمسفر اشاره کرد.
تبدیل الماس به گرافیت در دمای اتاق و فشارهای معمولی فرایندی خود به خودی است ، ولی در شرایط عادی با سرعت مناسب و قابل توجهی صورت نمی گیرد، به همین دلیل است که الماس هایی را که از منظومه ی شمسی هم قدیمی ترند نیز از شهاب سنگ ها جداسازی کرده اند.
* جالب است بدانید که :
اولین گزارش تولید مصنوعی الماس توسط ژ.ب.هنری (Henry. Zh. H) در سال 1880 منتشر شد. او ادعا کرد که به تولید الماس از هیدروکربن ها، روغن استخوان و لیتیوم دست یافته است ولی نتایج او هرگز تکرار نشد. اما برای تولید الماس مصنوعی تلاش های بسیاری شده است. الماس در سال 1955 پس از تلاش های زیاد با استفاده از گرافیت و فلز Ni که تا دمای 2000-1500 کلوین گرم شده بود و در فشار 7 گیگا پاسکال سنتز شد. برای تولید الماس، گرافیت و فلز هردو باید ذوب شوند و بنابراین دمای سنتز به نقطه ی ذوب فلز بستگی دارد. فلز Ni گرافیت را حل می کند و الماس که کمتر محلول است از آن متبلور می شود. اندازه، شکل و رنگ الماس حاصل به شرایط اعمال شده بستگی دارد. سنتز در دمای پایین بلورهای تیره ی ناخالص تولید می کند. در سنتز دمای بالا الماس بی رنگ تر و خالص تر به دست می آید. الماس های مصنوعی بیشتر به گرافیت و یا کاتالیست فلزی آلوده هستند.
همچنین بلورهای الماس را با گذاشتن یک بلور کوچک الماس، به عنوان هسته اولیه، می توان رشد داد ولی بلورهای حاصل از این رشد، نامتوازن و همراه با شکاف و دارای ذره های ناخالصی هستند.
درصورتی که دما وفشار سنتز به اندازه کافی بالا اختیار شود الماس را به طور مستقیم و بدون نیاز به کاتالیست فلزی می توان تهیه نمود. به این صورت که با یک شوک ناگهانی گرافیت برای چند میلی ثانیه در دمای 1000کلوین و تحت فشار 30گیگا پاسکال قرار می گیرد و بخشی از آن به الماس تبدیل می شود.
چون روش فشار بالا، تولید الماس پرهزینه و دشوار است، روشی که در فشار پایین الماس تولید کند بسیار جالب توجه خواهد بود. البته مدت هاست که دریافته اند که با نشاندن اتم های کربن روی یک سطح داغ در نبودن هوا، بلورهای ریز الماس آمیخته با گرافیت را می توان تولید نمود. اتم های کربن از تجزیه ی گرمایی متان بدست می آید و هیدروژن اتمی حاصل نیز در کمک به تولید الماس نقش مهمی را ایفا می نماید. یکی از ویژگی های هیدروژن اتمی واکنش سریع تر آن با گرافیت، در مقایسه با الماس و تولید هیدروکربن های فرار است که در نتیجه به بیرون راندن گرافیت می انجامد.
روش سنتز جدید امیدوار کننده ای که از نظر زیست محیطی مناسب تر و نیز ارزان تر از هر یک از روش های دما و فشار بالا است، استفاده از سیلیکون کاربید (SiC) است. از این ترکیب، کربن به صورت الماس در زیر گازهای Cl2 و H2 در فشار محیط و در دمای به نسبت پایینی (1300کلوین) استخراج می شود.
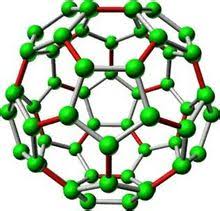
الماس و گرافیت تنها آلوتروپ های کربن نیستند. فولرن ها (که به زبان ساده “توپ های باکی” نامیده شده اند) در دهه ی 1980 کشف شدند و زمینه جدیدی در شیمی ترکیبات کربن به وجود آوردند. جایزه نوبل سال 1996 بخاطر کشف این آلوتروپ جدید از کربن به ریچارد اسمالی(Richard Errett Smalley) ، رابرت کرل(Robert Floyd Curl) و هارولد کروتو(Harold Walter Kroto) داده شد. فولرن انواع گوناگون و متعددی دارد و می تواند به صورت کره، بیضی گون و یا استوانه باشد. این مولکول های قفس مانند با فرمول های C70 و C60 و C78 شناخته شده اند. پایه فولرن ها صفحات موجود در گرافیت می باشد با این تفاوت که در ساختار اتمی فولرن ها بجای شش ضلعی های منظم موجود در صفحات گرافیت، یک سری شش ضلعی و پنج ضلعی منظم وجود دارد که به صورت یک در میان در کنار هم قرار گرفته و کره فولرن را تشکیل داده اند. قرارگیری این پنج ضلعی و شش ضلعی ها در کنار هم برای شکل دادن یک ساختار کروی ضروری است. فولرن ها از نظر مکانیکی مولکول های به شدت قوی ای هستند و تحمل فشار های بسیار زیاد را دارند از این رو از این خاصیت در تولید نانوکامپوزیت ها استفاده شده است.
-
رابرت کرل -
هارولد کروتو -
ریچارد اسمالی -
شکل مولکولی فولرن
[/vc_column_text][/vc_column][/vc_row][vc_row][vc_column width=”1/3″][/vc_column][vc_column width=”1/3″][tlg_button title=”از ما حمایت کنید .” btn_link=”url:https%3A%2F%2Fidpay.ir%2Fshimidoon|||” btn_size=”btn-block” layout=”btn btn-filled btn-light btn-rounded” hover=”hvr-pop” icon=”ti-money” button_icon_hover=”yes” css_animation=”fadeIn” customize_button=”yes” btn_custom_layout=”btn btn-rounded” btn_color=”#ffffff” btn_bg_gradient=”#870501″ btn_bg_gradient_hover=”#eded00″ btn_bg_hover=”#d80700″ btn_border_hover=”#43c100″ btn_bg=”#1e0000″][/vc_column][vc_column width=”1/3″][/vc_column][/vc_row]