در مقاله قبل درباره سینتیک واکنش های مرتبه اول صحبت کردیم و فرمول بندی آن را نیز بررسی کردیم. برای مطالعه آن مقاله اینجا را کلیک کنید. در این مقاله قصد داریم تا با سینتیک واکنش های مرتبه دوم آشنا شویم و فرمول بندی آن را نیز بررسی کنیم.
واکنش مرتبه دوم چیست؟
واکنش کلی زیر را در نظر بگیرید؛ اگر این واکنش، واکنشی از مرتبه دوم باشد. سینتیک آن به دو حالت قابل بررسی است.
ابتدا به بررسی حالت اول می پردازیم. در این حالت، قانون سرعت واکنش به صورت زیر بیان می شود:
این که یک واکنش مرتبه اول یا دوم یا اصلا مرتبه n باشد، از معادلات قابل تشخیص نبوده و صرفا از طریق آزمایشات اثبات می شود. بنابراین اگر در یک واکنش، دو یا چند واکنش دهنده با ضرایب مختلف وجود داشته باشد، صرفا با دیدن واکنش نمی توان مرته آن را تشخیص داد.
این که واکنش مرتبه چندم است و از چه فرمی طبعیت می کند در صورت سوال داده خواهد شد بنابراین تمرکز تان را روی یادگیری فرم های مختلف معطوف کنید. همه فرم ها را بلد باشید.
فرمول بندی سرعت واکنش در فرم اول:
خب، در این فرم از واکنش ها همچنین می توان سرعت واکنش را از رابطه زیر نیز محاسبه کرد و داریم:
با مساوی قرار دادن این دو فرم داریم:
به فرض این که ضریب استوکیومتری ماده A برابر 1 باشد داریم:
از حل این انتگرال داریم:
با استفاده از این فرمول می توان غلظت گونه A را در هر لحظه دلخواه به دست آورد و برای آن داریم:
برای به دست آوردن زمان نیمه عمر این واکنش کافی است که در فرمول بالا به جای [A] از [A0] استفاده کنید. در این صورت برای زمان نیمه عمر داریم:
فرمول بندی سرعت واکنش در فرم دوم:
برای واکنش های مرتبه دوم یک فرم دیگر نیز وجود دارد که به صورت زیر است:
در این مورد نیز همانند بالا، روند را دنبال می کنیم. در این صورت خواهیم داشت:
در این فرم نیز زمان نیمه عمر به صورت زیر است:
تشخیص سینتیک مرتبه دوم بودن واکنش از روی نمودار:
اگر نمودار بر حسب زمان رسم شود، به صورت خطی با شیب ثابت خواهد بود که در آن، عرض از مبدا برابر با
و شیب نمودار برابر با
خواهد شد. مثلا در نمودار زیر، منحنی برای فرآورده رسم شده است.
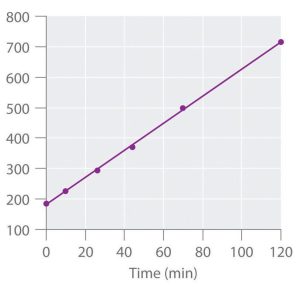
نمودار غلظت بر حسب زمان